Uhličitany jsou anorganické sloučeniny tvořené iontovou vazbou kovu nebo polokovu s uhličitanovým aniontem, CO32-.
Uhlík je čtyřmocný, to znamená, že má čtyři elektrony ve valenčním plášti a může vytvořit čtyři kovalentní vazby, aby byly stabilní, zatímco kyslík je bivalentní, má šest elektronů ve valenčním plášti a je schopen vytvořit dvě vazby, aby byly stabilní, s osmi elektrony. Existuje tedy silná tendence uhlíku vázat se na dva atomy kyslíku, z nichž všechny jsou stabilní (O ═ C ═ O → CO2).
Ale jiný kyslík se může kombinovat s uhlíkem, protože poměr iontových poloměrů vede ke koordinačnímu číslu rovnému 3 a vytváří strukturu trojúhelníkový, ve kterém je uhlík ve středu, tvoří dvojnou vazbu s jedním z atomů kyslíku a dvě jednoduché vazby s dalšími dvěma kyslíky. Výsledkem jsou dva přebytečné elektrony, protože tyto dva kyslíky nejsou stabilní a je nutné, aby každý přijímal jeden elektron:
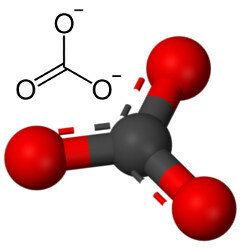
Uhličitanový anion je tvořen kovalentními vazbami, ale jeho sloučeninami, které jsou anorganické soli a minerály známé jako uhličitany, jsou iontové, protože tento radikál přijímá dva elektrony z nějakého kovu nebo polokovu a tvoří a iontová vazba.
Tyto sloučeniny jsou nerozpustné ve vodě, s výjimkou uhličitanu amonného ((NH4)2CO3) a uhličitany vytvořené s alkalickými kovy (prvky rodiny 1: Li, Na, K, Rb, Cs a Fr). Téměř všechny jsou bílé pevné látky, jak je znázorněno na obrázku níže:

Dva nejběžnější a nejdůležitější každodenní příklady uhličitanů jsou uhličitan sodný (Na2CO3) a uhličitan vápenatý (CaCO3). V prvním případě patří sodík do rodiny 1, který má elektron ve valenčním plášti a má tendenci tento elektron ztrácet, aby se stal stabilním. Protože uhličitanový anion potřebuje přijmout dva elektrony, váže se na dva atomy sodíku:
Nepřestávejte... Po reklamě je toho víc;)

Soda je lépe známá jako soda nebo soda, která se používá při výrobě mýdel, barviv, léků, papírů a při úpravě vody v bazénu. Ale jeho hlavní použití je při výrobě skla s uhličitanem vápenatým a pískem.
Vápník je rodina 2, která má tendenci ztrácet dva elektrony. Atom vápníku se tedy váže na uhličitanový radikál:

Uhličitan vápenatý je přítomen ve vápenci a mramoru. Na stalaktity a stalagmity které existují v jeskyních, jsou tvořeny tímto uhličitanem; mušle, korálové útesy a vaječné skořápky. Když bělíme stěny, kmeny stromů a jiná místa, používáme hydroxid vápenatý (Ca (OH)2), který v průběhu času reaguje s atmosférickým oxidem uhličitým za vzniku uhličitanu vápenatého.

Uhličitany jsou na zemském povrchu velmi časté, jako v případě minerálů. Jeho krystalické retikulum se může v prostoru přeskupit dvěma způsoby: ortorombickou (jak je tomu v případě minerálu aragonitu uvedeného výše společně se vzorcem uhličitanu vápenatého) a rhombohedrální nebo trigonální, jako je tomu v případě kalcitu (jiného minerálu sestávajícího z uhličitanu vápenatého).
Uhličitany reagují v přítomnosti kyselin a uvolňují CO2, což je snadno vidět na šumění.
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Uhličitany“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/carbonatos.htm. Zpřístupněno 28. června 2021.
Chemie

Uhličitan sodný, metoda Leblanc, metoda Ernesta Solvaye, uhličitan sodný, soda, výroba běžného skla, úprava vody v bazénu, kontrola pH vody, úprava textilu, potravinářské přídatné látky.
Chemie

Každodenní soli, uhličitan vápenatý, chlorid sodný, fluorid sodný, dusičnan draselný, dusičnan sodný sodík, uhličitan sodný, hydrogenuhličitan sodný, hydrogenuhličitan sodný, siřičitan sodný, ledek, soda.