Stejně jako cyklány, alkeny, alkyny, mimo jiné alkadienes také trpět hovory adiční reakce. V textu o reakce u dienů, zjistíte, že adiční reakce závisí na typu dienu, na kterém se pracuje. Dienes lze obecně rozdělit na:
kondenzované nebo akumulované (žádná jednoduchá vazba mezi těmito dvěma zdvojnásobí);
Příklad: H2C = CH-CH3
konjugované nebo střídané (pouze jednoduchá vazba mezi těmito dvěma zdvojnásobí);
Příklad: H2C = CH — CH = CH2
izolovaný (alespoň dvě jednoduché vazby mezi těmito dvěma zdvojnásobí).
Příklad: H2C = CH-CH2—CH2—CH = CH2
Diels-Alderova reakce byl vyvinut v roce 1928 dvěma německými chemiky, Otto Paul Hermann Diels a Kurt Alder. Jedná se o velmi důležitou reakci v rámci organické chemie, protože umožňuje:
identifikovat dienové uhlovodíky;
získat nasycené cyklické uhlovodíky (výhodně cyklohexany).
Tato organická reakce probíhá pouze v alkadienů nebo konjugovaných nebo střídaných dienů a je volán doplněk 1.4. Sloučeninou, ve které můžeme jednodušeji pozorovat přidání 1,4, je but-1,3-dien, zobrazený níže:
H2C = CH — CH = CH2
POZNÁMKA: V této sloučenině máme výskyt fenomén rezonance, ve kterém se elektrony ze dvou vazeb pí pohybují řetězcem. Pár elektrony pí začíná zabírat centrální oblast řetězce (mezi uhlíky 2 a 3), zatímco elektrony z druhé vazby pí jsou posunuty na jeden z koncových uhlíků. Máme tedy vazebná místa na uhlících 1 a 4 a dvojnásobek mezi uhlíky 2 a 3.

Rezonance ve struktuře but-2,3-dienu
Nepřestávejte... Po reklamě je toho víc;)
Na Diels-Alderova reakce, jedním z činidel je konjugovaný dien, zatímco druhým je organická sloučenina, která se může vyskytovat hovor dvojnásobek mezi atomy uhlíku. Níže je uveden příklad a Diels-Alderova reakce mezi but-2,3-dienem a propenem:
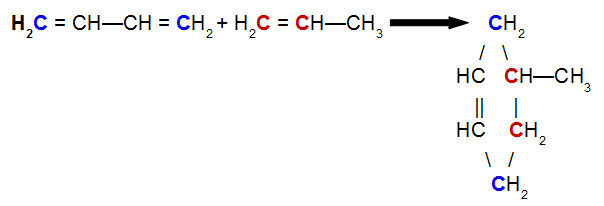
Rovnice Diels-Alderovy reakce but-2,3-dienu s propenem
Při analýze výše uvedené rovnice vidíme, že uhlíky 1 a 4 (oba modře) but-2,3-dienové vazby na uhlíky 1 a 2 (oba červené) propenu, což vede k rozvětvenému cyklenu, 4-methyl-cyklohexen. To je způsobeno rezonancí v molekule but-2,3-dienu, která posune vazbu pí mezi uhlíky 2 a 3, a zlomením vazby pí mezi uhlíky 1 a 2 propenu.
OBS.²: Je důležité zdůraznit, že bez ohledu na sloučeninu, která reaguje s konjugovaným alkadienem, dojde k přerušení vazby pí pouze mezi atomy uhlíku v řetězci. Pokud má struktura pi vazby mezi atomy jinými než uhlík, nebudou porušeny. Níže je uveden příklad struktury, která může reagovat s a alkadien v Diels-Alderova reakce, což má za následek rozbití vazby pí mezi uhlíky (modře) dvojné vazby.
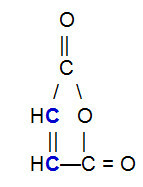
Strukturní vzorec anhydridu kyseliny maleinové
Podle mě. Diogo Lopes Dias
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
DNY, Diogo Lopes. „Diels-Alder Reactions“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/reacoes-diels-alder.htm. Zpřístupněno 28. června 2021.
Chemie

Alkeny, plyn, eten, ethylen, plasty, syntetický kaučuk, barviva, syntetické tkaniny, výbušniny, krakování ropy, polyethylen, olefiantní plyn, olefiny, uhlovodíky, řetěz acyklický oxid uhličitý.


