Před zavedením konceptu molární hmotnost a molární číslo, pojďme se podívat na některé důležité definice v této souvislosti:
→ Molární termín
Molární pochází ze slova molekula, ale co přesně je to molekula? Je to sada atomů, které jsou spojeny chemickými vazbami.
→ Molekulová hmotnost (MM)
Je možné vypočítat hmotnost molekuly součtem atomových hmotností každého atomu, který tvoří příslušnou molekulu. Výsledek se nazývá Molecular Mass (MM).
Jaká by byla molekulová hmotnost sirovodíku (H2S) například?
Nejprve musíte vědět, co je atomová hmotnost každého atomu, což je dáno Periodickou tabulkou z elementy.
Atomová hmotnost vodíku (H) = 1 a.m.u. (jednotka na atomovou hmotnost)
Atomová hmotnost síry (S) = 32,1 a.u.u.
Molekulová hmotnost je součet atomových hmotností atomů.
Poznámka: vodík molekuly H2S má koeficient 2, takže musíte vynásobit jeho hmotnost 2. Výpočet:
Molekulová hmotnost H2S = 1 • 2 + 32,1 = 34,1 u
(H) + (S) = (H)2S)
Molární hmotnost a počet krtků
Nepřestávejte... Po reklamě je toho víc;)
Molární hmotnost, stejně jako počet krtků, souvisí s
Avogadrova konstanta (6,02 x 1023) prostřednictvím následujícího konceptu:'' Počet elementárních entit obsažených v 1 molu odpovídá Avogadrově konstantě, jejíž hodnota je 6,02 x 1023 mol-1.''
Molární hmotnost je tedy hmotnost 6,02 x 1023 chemické entity a je vyjádřena v g / mol.
Myšlenková mapa - Mol
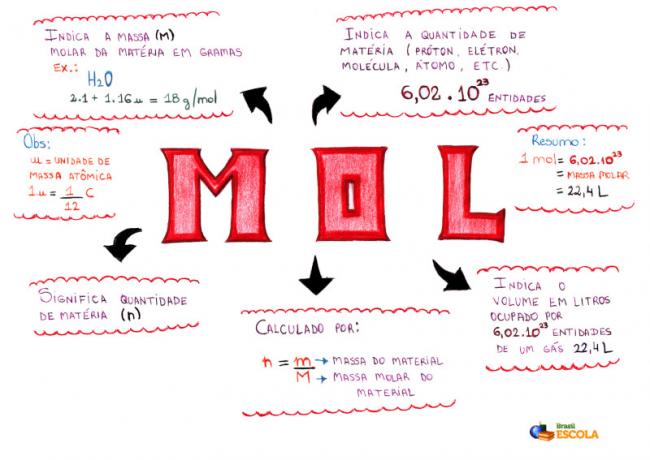
* Chcete-li stáhnout myšlenkovou mapu, Klikněte zde!
Příklad: H2s
Molekulová hmotnost = 34,1 u
Molární hmotnost (M) = 34,1 g / mol
To znamená, že při 34,1 g / mol sirovodíku máme 6,02 x 1023 molekuly nebo 1 mol molekul sirovodíku.
Závěr
Molekulová hmotnost a molární hmotnost mají stejné hodnoty, liší se jednotkou měření. Molární hmotnost souvisí s počtem molů, který je dán Avogadrovou konstantou.
* Mind Map by Me. Diogo Lopes
Líria Alves
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
SOUZA, Líria Alves de. "Molární hmotnost a počet molů"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/massa-molar-numero-mol.htm. Zpřístupněno 27. června 2021.

