Existuje vědní obor, který studuje rychlost chemických reakcí a faktory, které ji ovlivňují, se nazývá chemická kinetika. Chemické reakce lze definovat jako soubor jevů, ve kterých dvě nebo více látek reagují navzájem, čímž vznikají různé sloučeniny. Chemická rovnice je grafické znázornění chemické reakce, kdy se reaktanty objevují v prvním členu a produkty v druhém.
A + B  C + D
C + D
Reagenční produkty
Znalosti a studium reakcí, kromě toho, že jsou z průmyslového hlediska velmi důležité, souvisejí také s naším každodenním životem.
Rychlost reakce je, jak rychle se reaktanty spotřebují nebo jak rychle se tvoří produkty. Pálení svíčky a tvorba rzi jsou příklady pomalých reakcí. V dynamitu je rozklad nitroglycerinu rychlou reakcí.
Rychlosti chemických reakcí jsou určovány empirickými zákony, které se nazývají zákony rychlost, odvozená z vlivu koncentrace reaktantů a produktů na rychlost reakce.
Chemické reakce probíhají při různých rychlostech a ty lze změnit, protože navíc k koncentrace reaktantů a produktů, rychlost reakce závisí také na dalších faktorech jako:
Koncentrace činidlaČím vyšší je koncentrace reaktantů, tím rychlejší bude reakce. Aby reakce proběhla mezi dvěma nebo více látkami, je nutné, aby se molekuly srazily, aby došlo k rozbití vazeb s následnou tvorbou nových. Počet srážek bude záviset na koncentracích A a B. Viz obrázek:
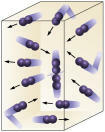
Molekuly se srážejí častěji, pokud
zvyšujeme počet reagujících molekul.
Nepřestávejte... Po reklamě je toho víc;)
Je snadné vidět, že díky vyšší koncentraci dojde ke zvýšení srážek mezi molekulami.
kontaktní plocha: Zvýšení kontaktní plochy zvyšuje rychlost reakce. Příkladem je, když rozpustíme rozdrcenou tabletu Sonrisal a ta se rozpustí rychleji než kdyby to bylo celé, stane se to proto, že zvětšíme kontaktní plochu, která reaguje s Voda.
Tlak: když zvýšíte tlak plynného systému, zvýší se reakční rychlost.
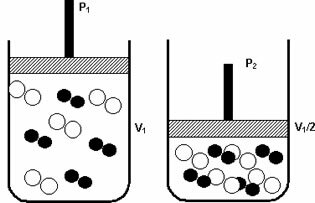
Zvýšení tlaku z P1 na P2 snížilo objem z V1 na V1 / 2 a urychlilo reakci v důsledku přístupu molekul.
Výše uvedený obrázek je příkladem, protože s poklesem objemu ve druhém kontejneru dojde ke zvýšení tlak zesilující srážky molekul a v důsledku toho zvýšení rychlosti reakce.
Teplota: když se zvýší teplota systému, dojde také ke zvýšení reakční rychlosti. Zvýšení teploty znamená zvýšení kinetické energie molekul. V každodenním životě můžeme tento faktor pozorovat, když vaříme, a zvyšujeme plamen kamen, aby jídlo dosáhlo stupně vaření rychleji.
Katalyzátory: Katalyzátory jsou látky, které urychlují mechanismus, aniž by prošly trvalou změnou, to znamená, že během reakce nejsou spotřebovány. Katalyzátory umožňují, aby se reakce vydala alternativní cestou, která vyžaduje méně aktivační energie, což způsobí, že reakce bude probíhat rychleji. Je důležité si uvědomit, že katalyzátor urychluje reakci, ale nezvyšuje výtěžek, to znamená, že produkuje stejné množství produktu, ale za kratší dobu.
Líria Alves
Vystudoval chemii
Chtěli byste odkazovat na tento text ve školní nebo akademické práci? Dívej se:
SOUZA, Líria Alves de. „Chemická kinetika“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/cinetica-quimica.htm. Zpřístupněno 27. června 2021.