كما هو موضح في النص تشبع الحلول، تتشكل المحاليل الكيميائية عن طريق تفكك أ المذاب على مذيب. كل مادة مذابة لها ملف معامل الذوبان محدد ، وهو الحد الأقصى لمقدار الذوبان في كمية معينة من المذيب عند معين درجة الحرارة.
بناء رسم بياني بمنحنى الذوبان
على سبيل المثال ، ملف معامل الذوبان من KNO3 هو 31.2 جرام في 100 جرام من الماء عند 20 درجة مئوية. إذا قمنا بإذابة هذه الكمية بالضبط من نترات البوتاسيوم في 100 جرام من الماء عند 20 درجة مئوية ، محلول مشبع. أي كمية إضافية من هذا الملح سوف تترسب (تشكل جسمًا سفليًا في الحاوية).

ومع ذلك ، فإن معامل الذوبان يختلف باختلاف درجة الحرارة. لذلك ، إذا قمنا بتسخين هذا المحلول المشبع بجسم KNO السفلي3، سوف يذوب الراسب تدريجياً في الماء. انظر أدناه قيم معاملات الذوبان KNO3 في 100 جرام من الماء بدرجات حرارة مختلفة:
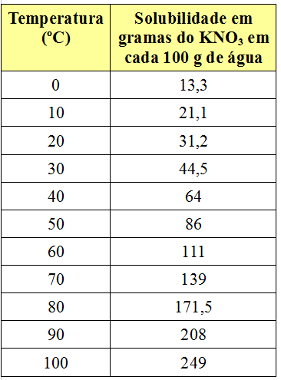
نلاحظ أن الذوبان من هذا الملح في الماء يزداد مع زيادة درجة الحرارة. هذا هو الحال أيضًا في معظم المواد. إذا وضعنا هذه القيم في ملف الرسمسيكون لدينا ما يلي:
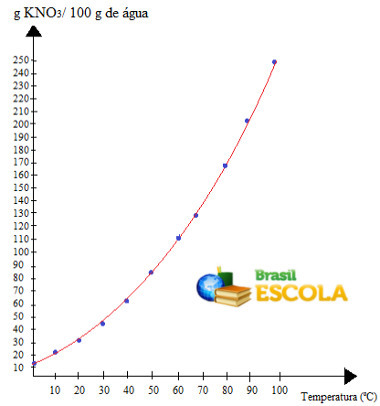
هذه هي النداء منحنى الذوبان من KNO3. نقول إنها تصاعدية لأنها تنمو مع زيادة درجة الحرارة.
خصائص منحنيات الذوبان في المذاب في الرسم البياني
كل مادة لها منحنى الذوبان لمذيب معين. بعض هذه المواد قللت من قابلية الذوبان مع زيادة درجة الحرارة ، كما هو الحال في CaCrO4، التي لديها منحنى الذوبان إلى أسفل. هذا يعني أنه إذا قمنا بتسخين محلول مشبع من هذا الملح ، فإن بعض الملح المذاب سوف يترسب.
أما بالنسبة للمواد الأخرى ، فإن الزيادة في درجة الحرارة لا تتدخل كثيرًا في قابلية الذوبان ، كما يحدث مع محلول ملح الطعام (كلوريد الصوديوم). عند 20 درجة مئوية ، يكون معامل الذوبان لكلوريد الصوديوم 36 جم في 100 جم من الماء ، ولكن إذا قمنا بزيادة درجة الحرارة إلى 100 درجة مئوية ، فإن قابلية الذوبان هذه ستزيد فقط إلى 39.8 جم ، وهي زيادة طفيفة جدًا.
هناك أيضًا مواد تزداد فيها قابلية الذوبان فقط إلى درجة معينة من زيادة درجة الحرارة ، لأنه بعد ذلك تنخفض قابلية الذوبان. يحدث هذا ، على سبيل المثال ، مع المواد المميعة ، والتي ، عند تسخينها ، تصل إلى وقت تجف فيه. لذلك ، مع تغير تركيبته ، يتغير أيضًا تغير قابليته للذوبان مع درجة الحرارة. يمكن ملاحظة هذا الحدوث في الرسم البياني من خلال الانحرافات في منحنى الذوبان.
أدناه ، نقدم أ الرسم البياني مع منحنيات الذوبان من مواد مختلفة:
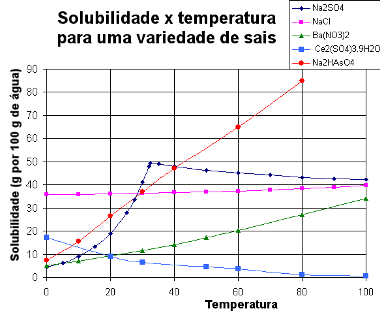
منحنيات الذوبان للأملاح المختلفة
من خلال هذا النوع من الرسم البياني ، يمكننا مقارنة قابلية ذوبان الأملاح المختلفة في نفس المذيب وفي نفس درجات الحرارة.
تصنيف الحل باستخدام رسم بياني بمنحنى الذوبان
في منحنيات الذوبان كما أنها تساعد في تحديد تشبع الحلول ، أي ما إذا كانت غير مشبعة أو مشبعة أو خلفية مشبعة أو مفرطة التشبع. شاهد مثالاً:
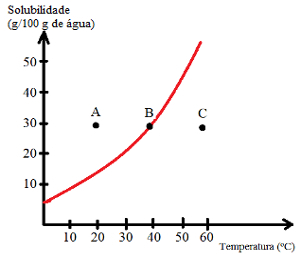
تعرف على أنواع الحلول المشار إليها بالنقاط A و B و C:
ج: مشبع بقاع الجسم. عند النقطة أ ، يذاب 30 جم من المذاب في 100 جم من الماء عند 20 درجة مئوية. يوضح المنحنى أنه عند هذه النقطة يكون معامل الذوبان حوالي 15 جم / 100 جم من الماء. وبالتالي ، نظرًا لأن كمية المذاب الموجودة أكبر ، يتم الحصول على محلول مشبع بجسم سفلي.
ب: مشبع. تقع النقطة B بالضبط على منحنى القابلية للذوبان ، مما يشير إلى أن المحلول مشبع ، حيث يوجد 30 جم من المذاب المذاب في 100 جم من الماء عند 40 درجة مئوية. هذا ، إذن ، هو بالضبط معامل الذوبان لهذا المذاب عند درجة الحرارة هذه.
ج: غير مشبع. يوجد 30 جم من المذاب المذاب في 100 جم من الماء عند 60 درجة مئوية. يوضح المنحنى أنه عند هذه النقطة يكون معامل الذوبان أكبر من 50 جم / 100 جم من الماء. وبالتالي ، نظرًا لأن كمية المذاب المذاب أقل من معامل الذوبان ، يوجد محلول غير مشبع.
وهكذا يمكننا أن نستنتج أن:
النقاط فوق المنحنى: المحاليل المشبعة بجسم الخلفية ؛
النقاط على المنحنى: المحاليل المشبعة ؛
نقاط تحت المنحنى: حلول غير مشبعة.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/graficos-das-curvas-solubilidade.htm
