نظرًا لوجود الآلاف من المركبات العضوية ، يمكن أن تتخذ ظاهرة التماكب عدة أشكال. لذلك ، يمكن تصنيف التماثل إلى نوعين: التماثل المسطح أو الدستوري و تماثل الفضاء أو الفراغية. يمكن تقسيم كل نوع مذكور ، كما هو موضح في الرسم البياني التالي:
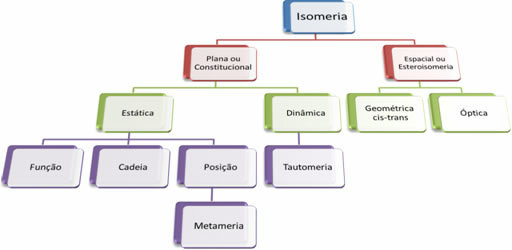
انظر كل حالة:
1. التماثل المسطح أو الدستوري: الايزومرات من هذا النوع لها نفس الصيغة الجزيئية وتتميز بالصيغ التركيبية المسطحة. هناك خمس حالات من التماثل المستوي: الوظيفة ، والسلسلة ، والموضع ، والميتاميريزم ، والتوتوميرزم.
1.1.التزاوج الوظيفي أو الوظيفي: الفرق بين الايزومرات في المجموعة الوظيفية.
مثال: الصيغة الجزيئية ج3ح6ا
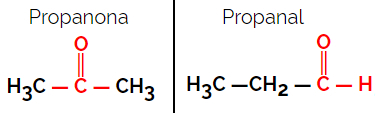
لاحظ أن البروبانون من مجموعة الكيتون والبروبانال من مجموعة الألدهيد.
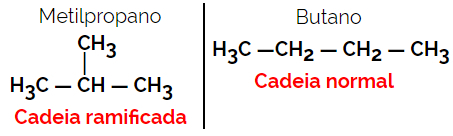
1.2. سلسلة أو أيزومرات هيكلية: يكمن الاختلاف بين الأيزومرات في نوع السلسلة. على سبيل المثال ، أحد الأيزومرين عبارة عن سلسلة مفتوحة والآخر سلسلة مغلقة ، أو أحدهما عبارة عن سلسلة عادية والآخر ذو سلسلة متفرعة ، أو أحدهما عبارة عن سلسلة متجانسة والآخر سلسلة غير متجانسة.
مثال: الصيغة الجزيئية ج4ح10
1.3.التزمير الموضعي أو الموضعي: يكمن الاختلاف في موضع عدم التشبع ، أو مجموعة وظيفية ، أو ذرة غير متجانسة ، أو بديل.
مثال: الصيغة الجزيئية ج4ح6

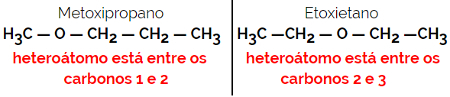
1.4.ايزومرية التعويض أو ميتامري: إنه نوع خاص من تماثل الموضع ، حيث يكون الاختلاف هو موضع الذرة غير المتجانسة.
مثال: الصيغة الجزيئية ج4ح10ا
1.5.Isomery ديناميكي أو Tautomery: إنه نوع خاص من التماثل الوظيفي ، حيث تتعايش الأيزومرات في توازن ديناميكي في المحلول. النوعان الرئيسيان من التكثيف هما بين كيتون وإينول (توازن كيتوينول) وبين ألدهيد وإينول (توازن ألدوينول).
مثال: الصيغة الجزيئية ج3ح6ا
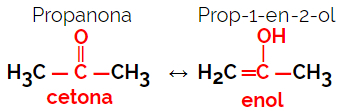
2. تماكب الفضاء أو الأيزومرية الفراغية: في هذه الحالة ، لا يمكن تصور الفرق بين الأيزومرات إلا من خلال توجيه ذراتها في الفضاء. هناك نوعان من الأيزومرية الفراغية: التماثل الهندسي والتماكب البصري.
2.1.هندسية أو أيزومرات رابطة الدول المستقلة: الاختلاف هو أن الأيزومر يسمى رابطة الدول المستقلة لها نفس روابط الكربون في رابطة مزدوجة أو في مركبات دورية على نفس الجانب من المستوى. يجند الأيزومر عبر على طرفي نقيض.
مثال: الصيغة الجزيئية ج2ح2Cl2

تسمى هذه المركبات الأيزومرات الفراغية.
2.2.الايزومير البصري: يحدث عندما تكون الأيزومرات قادرة على تحويل شعاع من الضوء المستقطب. إذا كان ينحني شعاع الضوء المستقطب إلى اليسار ، فهو أيزومر ليفوروتاري ، ولكن إذا انحنى إلى اليمين يسمى أيزومر أيمن.
مثال:
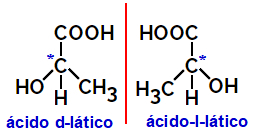
تسمى الجزيئات غير المتماثلة مثل تلك الموضحة أعلاه ، والتي هي صور معكوسة لبعضها البعض والتي لا يمكن تركيبها ، المتشاهدين.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm

