يسمى شعاع أيون بحجم أيون. تعتمد دراسة هذه الخاصية على المعرفة حول نصف القطر الذري والأيونات.
نصف القطر الذري: هو مقياس لحجم الذرة المحايدة (المسافة النظرية من النواة إلى الغلاف الكهربائي الأخير).
الأيونات: الذرات التي تفقد (الكاتيونات) أو تكتسب إلكترونات (الأنيونات).
البروتونات داخل نواة أ ذرة تمارس قوة جذب على الإلكترونات (الجسيمات السالبة) الموجودة في الكرات الكهربائية. كلما زاد عدد البروتونات ، زاد هذا الجذب والعكس صحيح. عندما يتم تعديل عدد الإلكترونات في الذرة بفقدان أو كسب هذه الجسيمات ، يتم تعديل التجاذب بين البروتونات والإلكترونات على النحو التالي:
في حالة الكاتيون:
يصبح عدد الإلكترونات في الكرات الكهربائية أقل من عدد البروتونات داخل النواة ، مما يجعل قوة جذب النواة أكبر ، مما يجعل الإلكترونات أقرب إليها. الكرات الكهربائية. والنتيجة هي انخفاض نصف قطر الذرة. وبالتالي ، فإن نصف قطر الكاتيون سيكون دائمًا أصغر من نصف قطر ذرته المحايدة.
نصف قطر ذرة محايدة> نصف قطر الموجبة
في حالة الأنيون:
يصبح عدد الإلكترونات في الكرات الكهربائية أكبر من عدد البروتونات داخل النواة. في هذه الحالة ، يتم التغلب على قوة الجذب التي تمارسها النواة بقوة التنافر بين الإلكترونات الموجودة في الكرات الكهربائية ، والنتيجة هي زيادة نصف قطر الذرة. وبالتالي ، فإن نصف قطر الأنيون سيكون دائمًا أكبر من نصف قطر ذرته المحايدة.
نصف قطر أنيون> نصف قطر ذرة محايد
الحالتان الواردتان أدناه هما مثالان جيدان لما يحدث لنصف قطر أيون:
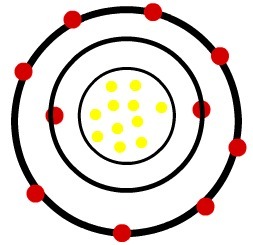
1) ذرة الصوديوم المحايدة (11Na) وكاتيون الصوديوم (11في+)
بينما تحتوي ذرة الصوديوم المحايدة على أحد عشر بروتونًا (كرات صفراء) وأحد عشر إلكترونًا (كرات حمراء) ، فإن كاتيون الصوديوم يحتوي على أحد عشر بروتونًا وعشرة إلكترونات.

نموذج ذرة الصوديوم المحايدة
عندما تفقد ذرة الصوديوم المحايدة إلكترونًا ، يتناقص نصف القطر.
نموذج من كاتيون الصوديوم
ملاحظة: المستوى الثالث لم يتم تمثيله في صورة الكاتيون لأنه فقد الإلكترون الوحيد الذي كان لديه أصبح فارغًا وبالتالي تم تجاهله ولكنه موجود.
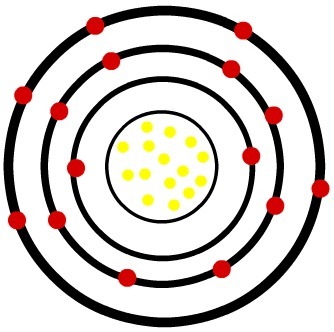
2) ذرة الفوسفور المحايدة (15ع) وكاتيون الفوسفور (15ص-3)
بينما تحتوي ذرة الفسفور المحايدة على خمسة عشر بروتونًا (كرات صفراء) وخمسة عشر إلكترونًا (كرات حمراء) ، فإن أنيون الفوسفور يحتوي على خمسة عشر بروتونًا وثمانية عشر إلكترونًا.
نموذج لذرة الفوسفور المحايدة
عندما تكتسب ذرة الفوسفور المحايدة ثلاثة إلكترونات ، يزداد نصف القطر.
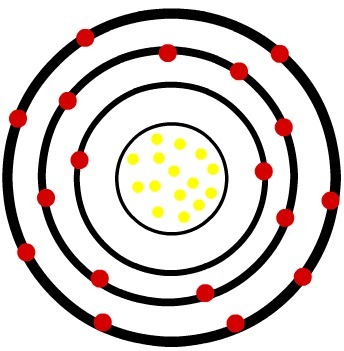
نموذج لأنيون الفوسفور
بي ديوغو لوبيز دياس


