لا تحتاج بعض المركبات إلى وجود ثمانية إلكترونات في غلاف التكافؤ لتحقيق الاستقرار ، لذا فهي تُعتبر استثناءات لقاعدة الثمانية. تعرف الآن على سبب إفلات بعض العناصر من التزام وجود ثماني بتات من الإلكترونات في الغلاف الأخير.
البريليوم (يكون)
إنه استثناء لقاعدة الثمانية لأنه قادر على تكوين مركبات ذات رابطتين منفردتين ، لذلك فهو يستقر بأربعة إلكترونات فقط في غلاف التكافؤ. 
بما أن الهيدروجين (H) يحتاج إلى التخلي عن إلكترونين لتكوين الرابطة (ح - حسنا - ح) ، تشترك ذرة البريليوم (Be) في إلكتروناتها وتحقق الاستقرار.
الألومنيوم (آل)
إنه استثناء لقاعدة الثمانية لأنه يحقق الاستقرار بستة إلكترونات في غلاف التكافؤ. تميل ذرة الألمنيوم إلى التبرع بإلكتروناتها وبالتالي يمكنها تكوين ثلاث روابط مفردة مع ذرات أخرى: 
في هذه الحالة ، شكل الألومنيوم (Al) ثلاث روابط مع ثلاث ذرات فلورين (F).
البورون (ب)
إنها تشكل مواد جزيئية بثلاث روابط مفردة. 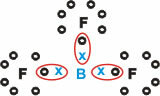
لاحظ أن البورون (B) يميل إلى التبرع بإلكتروناته لذرات الفلور (F) ، التي تخضع لقاعدة الثمانية ، والتي تتطلب ثمانية إلكترونات في غلاف التكافؤ. عندما يتخلى البورون عن إلكتروناته ، يستقر الفلور مع تشكل الثماني.
بقلم ليريا ألفيس
تخرج في الكيمياء
فريق مدرسة البرازيل
شاهد المزيد!
نظرية الثماني
كيمياء عامة - كيمياء - مدرسة البرازيل
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/excecoes-regra-octeto.htm

