في العديد من الأدوية والمنتجات الغذائية السائلة والصلبة مثل الخل والبسكويت على سبيل المثال المحتوى في النسبة المئوية من كتلة المذاب (م1) بالنسبة إلى كتلة المحلول بأكمله (م = م1 + م2). هذا الحجم يسمى العنوان (T) أو النسبة المئوية الكتلية من حل.
يمكن التعبير عن تعريفه على النحو التالي:

وبالتالي ، يتم حسابها من خلال المعادلة الرياضية أدناه:
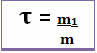
أو

نظرًا لأن كلا من المقام والبسط يتعاملان مع نفس الوحدة (وحدة الكتلة هي جرام - جم) ، فإن العنوان لا يحتوي على وحدة وهو أقل من 1.
وبالتالي ، إذا قلنا أن عنوان حل معين هو 0.4 ، فهذا يعني أنه بالنسبة لكل وحدة كتلة من المحلول ، يتوافق 0.4 مع كتلة المذاب. ومع ذلك ، غالبًا ما يتم التعبير عن العنوان كنسبة مئوية. للقيام بذلك ، ما عليك سوى ضرب القيمة التي تم العثور عليها في 100٪. في هذه الحالة يطلق عليه نسبة الكتلة (تي%) *
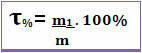
لاحظ الشكل أدناه ، حيث تُعطى النسبة المئوية لكلوريد الصوديوم في محلول ملحي بالكتلة:

يستخدم المحلول الملحي في علاج الجفاف ويحتوي على نسبة كتلية من كلوريد الصوديوم بنسبة 0.9٪.
في هذه الحالة ، فهذا يعني أنه لكل 100 جم أو 100 وحدة من هذا المحلول ، يوجد 0.9 جم أو 0.9٪ من المذاب ، أي من كلوريد الصوديوم (ملح الطعام - NaCl).
مثال آخر هو الخل: يوجد على الملصق الخاص به مؤشر على استخدام 5٪ من كتلة حمض الأسيتيك في تحضيره ، أي أنه يوجد 5 جرام من هذا الحمض لكل 100 جرام من المحلول.

يمكن أيضًا إعطاء العنوان بتنسيق نسبة الحجم. في هذه الحالة ، الاختلاف الوحيد هو أنه بدلاً من ربط كتلة المذاب بكتلة المحلول ؛ يرتبط حجم المذاب بحجم المحلول ، وفقًا للصيغة التالية:
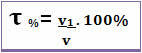
على سبيل المثال ، في حالة الكحول العادي ، الذي يحتوي على نسبة مئوية بالحجم 96٪ ، في 100 مل من المحلول ، 96 مل هو كحول.

* يستخدم مصطلح "العنوان" بشكل أكبر بين العلماء ، بينما يستخدم الفنيون والعديد من مؤلفي الكتب تعبير "النسبة المئوية للكتلة" في كثير من الأحيان.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/titulo-ou-porcentagem-massa.htm

