أ المجال الكهربائي هي منطقة الذرة التي الإلكترونات تقع. يتكون الغلاف الكهربائي، بشكل أكثر دقة، من مدارات ذرية، ويتم تحديده من خلال حل معادلة شرودنغر. تم تحديد الغلاف الكهربائي لأول مرة بواسطة نموذج رذرفورد، وقد تلقى تطورات كبيرة خلال صلاحية نموذج بور الذري.
يمكن تقسيم الغلاف الكهربائي إلى طبقات (أو مستويات طاقة)، حيث تمتلك الإلكترونات طاقة محددة (غير مستمرة). بالنسبة للذرات التي تحتوي على إلكترونين أو أكثر، تنقسم الأغلفة إلى أغلفة فرعية (أو أغلفة فرعية). يعد الغلاف الكهربائي مهمًا للغاية لفهم خصائص الذرة وفهم تكوين الروابط الكيميائية.
إقرأ أيضاً: كيف يتم انقسام الذرة؟
المواضيع في هذه المقالة
- 1- ملخص الغلاف الكهربي
- 2- درس فيديو عن المجال الكهربائي
- 3- ما هو المجال الكهربائي ؟
- 4- طبقات الغلاف الكهربي
- 5- وظيفة المجال الكهربائي
- 6- العلاقة بين الغلاف الكهربائي والتركيب الذري
- 7- حل التمارين على المجال الكهربي
ملخص عن المجال الكهربائي
الغلاف الكهربائي هو منطقة الذرة التي توجد فيها الإلكترونات.
وهي تتألف من مدارات ذرية، ووظائف موجية تمثل حلولاً لمعادلات شرودنغر.
بدأ مفهومها بنموذج إرنست رذرفورد.
يتم الاحتفاظ بالإلكترونات في الغلاف الكهربائي بسبب جاذبيتها للنواة الذرية.
حدثت التطورات الرئيسية في فهم الغلاف الكهربائي أثناء تصور نموذج نيلز بور.
وتتكون من طبقات (أو مستويات طاقة)، وهي مناطق ذات طاقة محددة.
بالنسبة للذرات التي تحتوي على أكثر من إلكترون واحد، تنقسم الأغلفة إلى مدارات فرعية (أو مدارات فرعية).
الغلاف الكهربائي مهم لفهم العديد من الخصائص، مثل التشابه الذري، والاستقرار، نصف القطر الذري، طاقة التأين، الألفة الإلكترونية، بالإضافة إلى فهم تكوين الروابط مواد كيميائية.
درس فيديو عن المجال الكهربائي
ما هو المجال الكهربائي؟
يتم تعريف الغلاف الكهربائي على أنه منطقة التركيب الذري التي توجد فيها الإلكترونات. وفي تفسيرات أكثر تعمقا، نقول إنها مكونة من مدارات ذرية، وهي دوال موجية تمثل حلولا لمعادلة شرودنغر. يمثل التعبير الرياضي للمدار الذري، عند تربيعه، الكثافة الاحتمالية لموقع الإلكترون عند نقطة معينة.
يا بدأ مفهوم الغلاف الكهربائي في الظهور مع ظهور النموذج الذري لإرنست رذرفورد، والتي تتميز بإلكترونات تدور حول نواة كثيفة وموجبة. لاحقًا، قدم نيلز بور تفسيرات أكثر أهمية للغلاف الكهربائي عن طريق مزج مفاهيم من ميكانيكا الكم.
لا تتوقف الان... هناك المزيد بعد الإعلان ;)
طبقات الغلاف الكهربائي
يتم الاحتفاظ بالإلكترونات في الغلاف الكهربائي بسبب جاذبيتها للنواة الذرية. ومع ذلك، فمن المعروف أن هؤلاء توجد الإلكترونات في أغلفة ذات طاقات محددة جيدًا. يمكن أيضًا تسمية هذه الطبقات بمستويات الطاقة.
وجاء هذا الاستنتاج بعد تجارب التحليل الطيفي. على سبيل المثال، عند تطبيق تيار كهربائي على الغاز H2 عند الضغط المنخفض، ينبعث الضوء بواسطة H2. في هذه الحالة، يتم تشكيل أيونات H+ والإلكترونات، والتي سوف تعود إلى الأيونات H+ وسوف تشكل أنواعًا متحمسة (نشطة) من H+. لتخفيف الطاقة الزائدة، أيونات H+ إطلاق الطاقة على شكل إشعاع كهرومغناطيسي (ضوء) وإعادة تجميعه في غاز H2 مرة أخرى.
ربما تتذكر أنه عندما يمر الضوء الأبيض عبر المنشور، فإنه ينقسم إلى طيف مستمر (يشبه قوس قزح)؛ ومع ذلك، فإن الشيء نفسه لا يحدث مع الضوء القادم من H2: عندما يمر هذا الإشعاع عبر المنشور، يتم ملاحظة خطوط ساطعة فقط ذات طول موجي محدد في طيف الانبعاث H2والمعروفة بالخطوط الطيفية.
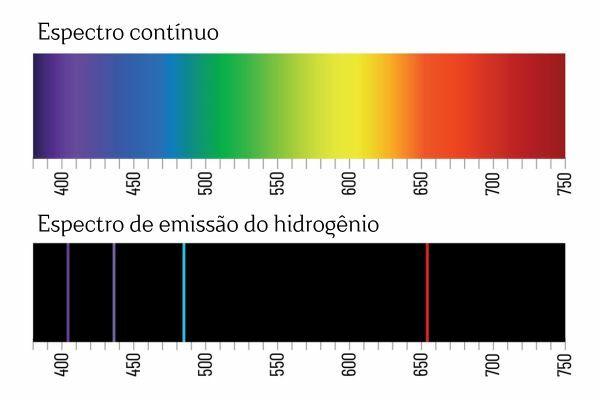
تفسير أطياف الانبعاث للعناصر (مع خطوط طيفية محددة جيدًا) هو ذلك إلكترون، في الذرة، لا يمكنها تقديم أي طاقة، بل بكميات محددة جيدًا (ما يسمى بحزم الطاقة). إذا لم يكن للإلكترونات مثل هذه القيود في الطاقة، لكان طيف انبعاث العناصر مستمرًا، تمامًا مثل الضوء الأبيض الذي يمر عبر المنشور.
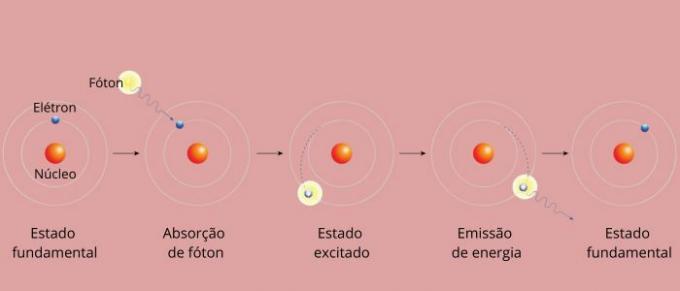
أصبح كل خط طيفي لعنصر ما يعرف بمستوى الطاقة. (أو طبقة، كما اعتدنا أن نقول). تنشأ هذه الخطوط عندما ينتقل الإلكترون من مستوى طاقة مسموح به إلى آخر، في عملية تغير الطاقة المعروفة باسم التحول الإلكتروني.
أثناء التحول الإلكتروني، ينتقل الإلكترون من مستوى طاقة أقل إلى مستوى طاقة أعلى. وعند عودته إلى مستواه الأولي، فإنه يبعث طاقة زائدة من خلال الإشعاع الكهرومغناطيسي (الضوء)، مما يعطي الأصل إلى الخط الطيفي الذي تتناسب قيمة طاقته المنبعثة مع القيمة المحددة بواسطة معادلة ريدبيرج.
كان يوهانس ريدبيرج عالمًا طيفيًا سويديًا ابتكر معادلة لتحديد اتجاه الخطوط الطيفية بناءً على عمل البروفيسور السويسري يوهان بالمر. يتم تحديد الطاقة المحددة لكل طبقة من خلال حل معادلة شرودنغر المناسبة.
تحتوي كل طبقة إلكترونية على عدد مسموح به من الإلكترونات. حاليًا، يتم تعريف سبع طبقات إلكترونية، يتم تحديدها بالأحرف K إلى Q، بالترتيب الأبجدي، أو بالحرف n، حيث n ≥ 1. وبالتالي، فإن الطبقة K هي الطبقة التي يكون فيها n = 1، وهكذا. يوضح الجدول التالي عدد الإلكترونات المسموح بها لكل غلاف.
مستوى الطاقة |
طبقة |
الحد الأقصى لعدد الإلكترونات |
1 |
ك |
2 |
2 |
ل |
8 |
3 |
م |
18 |
4 |
ن |
32 |
5 |
يا |
32 |
6 |
ص |
18 |
7 |
س |
8 |
بالنسبة للذرات الهيدروجينية (التي تحتوي على إلكترون واحد فقط، مثل H وHe+، لي2+)، جميع المدارات الذرية لها نفس الطاقة (نسميها المدارات المتدهورة)؛ ومع ذلك، في الذرات التي تحتوي على إلكترونين أو أكثر، ينشأ تأثير مهم جدًا، وهو تنافر إلكترون-إلكترون. نتيجة هذه الحقيقة هي أن مدارات كل طبقة تبدأ في الحصول على طاقات مختلفة، وبالتالي، تبدأ الطبقات في وصفها بأنها طبقات فرعية (أو مستويات فرعية).
بالنسبة للذرات الحالية، يمكن أن تتحلل كل طبقة إلى ما يصل إلى أربعة مستويات فرعية، ويمثلها الحروف "s" (من الإنجليزية، حاد)، "ص" (من الإنجليزية، رئيسي)، "د" (من الإنجليزية، انتشاري) و"f" (من الإنجليزية، أساسي).
يدعم كل مستوى فرعي الحد الأقصى لعدد الإلكترونات، الذي تحدده الحسابات والتجارب. يدعم المستوى الفرعي "s" ما يصل إلى إلكترونين؛ المستوى الفرعي "p" والذي يصل إلى 6 إلكترونات؛ المستوى الفرعي "d" والذي يصل إلى 10 إلكترونات؛ والمستوى الفرعي "f" يصل إلى 14 إلكترونًا. الطبقة K هي الطبقة الوحيدة التي تسمح بمدار واحد فقط، وبالتالي، لديها مستوى فرعي واحد فقط.
مستوى الطاقة |
طبقة |
المستويات الفرعية |
1 |
ك |
1 ثانية |
2 |
ل |
2س، 2ص |
3 |
م |
3S، 3P، 3D |
4 |
ن |
4س، 4ف، 4د، 4و |
5 |
يا |
5ث، 5ع، 5د، 5و |
6 |
ص |
6S، 6P، 6D |
7 |
س |
7س، 7ص |
وظيفة الغلاف الكهربائي
الغلاف الكهربائي لكل ذرة يمكن استخدامها لشرح خصائص وسلوكيات الذرة المختلفة.
خصائص مثل نصف القطر الذري ونصف القطر الأيوني وطاقة التأين وتقارب الإلكترون لها قيم هي نتيجة مباشرة للتكوين الإلكتروني للغلاف الكهربائي، وبشكل أكثر تحديدا تسمى قذيفة التكافؤ، وهو في الواقع الغلاف الإلكتروني الخارجي للذرة أو الأيون.
أ التشابه بين الذرات من نفس المجموعة في الجدول الدوري هو أيضًا نتيجة للتكوين الإلكتروني من قذيفة التكافؤ. في العمليات الكيميائية، نختار الذرات من نفس المجموعة في الجدول الدوري قدر الإمكان البدائل، وهذا أمر معقول فقط، لأن هذه الذرات لها نفس التكوين الإلكتروني في الطبقة من التكافؤ.
الى الروابط الكيميائية، والتي تحدث بين الذرات لتكوين مركبات (جزيئات) أيونية وتساهمية، وتحدث أيضًا من خلال التفاعلات بين المجالات الكهربائية للذرات.
اقرأ أيضًا: نموذج شرودنغر الذري – طريقة لوصف الذرة باستخدام ميكانيكا الكم
العلاقة بين الغلاف الكهربائي والبنية الذرية
كما ذكرنا سابقًا، يشمل الغلاف الكهربائي منطقة الذرة التي يمكن العثور على الإلكترونات فيها. توجد الإلكترونات، بشكل أكثر تحديدًا، في المدارات الذرية، والتي لها طاقة محددة من خلال الحسابات الكمومية.
الغلاف الكهربائي هو أكبر منطقة في التركيب الذريلأن نواة الذرة صغيرة جداً. إذا نظرنا إلى الذرة كملعب كرة قدم، فإن النواة ستتوافق مع كرة في وسط الملعب، في حين أن بقية الملعب سيكون بمثابة الغلاف الكهربائي.
ومع ذلك، ومن حيث الكتلة، يساهم الغلاف الكهربائي قليلًا. وبما أن كتلة الإلكترونات أصغر بحوالي 1836 مرة من كتلة البروتونات والنيوترونات، فيمكننا القول أن كتلة الذرة كلها تقريبًا تتركز في النواة.
تمارين محلولة على المجال الكهربائي
السؤال رقم 1
(Facisb 2023) في نموذج بور لذرة الهيدروجين، يمكن للإلكترون أن يشغل مدارات معينة فقط. يتم تمثيل بعض هذه المدارات في الشكل، حيث تشير n إلى مستويات الطاقة التي يمتلكها الإلكترون في كل مدار.
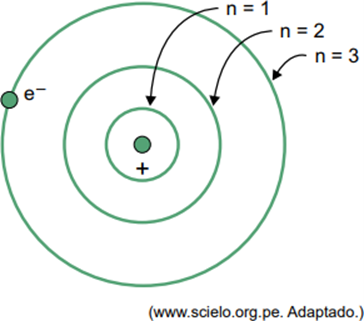
لنفترض أنه في ذرة الهيدروجين، يوجد الإلكترون في مدار حيث n = 5.
وفقًا لنموذج بور، فإن هذا الإلكترون سوف ينبعث طاقة على شكل إشعاع كهرومغناطيسي فقط عندما يكون
(أ) قم بالانتقال إلى المدار الذي فيه n يساوي 6.
(ب) البقاء في المدار حيث n = 5.
(ج) الانتقال إلى أي مدار يكون فيه n أكبر من 5.
(د) الانتقال إلى أي مدار يكون فيه n أقل من 5.
(هـ) يتم إخراجها من الذرة، مما يؤدي إلى تأينها.
الجواب: حرف د
عندما يكون الإلكترون في غلاف خارجي، عند عودته إلى غلاف داخلي بطاقة أقل، فإنه يطلق طاقة زائدة على شكل إشعاع كهرومغناطيسي (ضوء). لذلك، فإن حدوث الضوء لن يحدث إلا عندما ينتقل الإلكترون الموجود في n = 5 إلى الغلاف الداخلي.
السؤال 2
(أورج 2019) تمكن العلماء مؤخرًا من إنتاج الهيدروجين المعدني عن طريق ضغط الهيدروجين الجزيئي تحت ضغط عالٍ. الخصائص المعدنية لهذا العنصر هي نفس العناصر الأخرى في المجموعة 1 من جدول التصنيف الدوري.
ويرتبط هذا التشابه بالمستوى الفرعي الأكثر نشاطًا لهذه العناصر، والذي يتوافق مع:
(أ) م.س1
(ب) ن.ب.2
(ج) غ3
(د) ن.ف4
الجواب: حرف أ
تحتوي ذرة الهيدروجين على إلكترون واحد فقط، وهو يقع في المستوى الأول، المستوى الفرعي "s" (1s1). أحد أسباب وجوده في المجموعة 1 من الجدول الدوري هو أن جميع العناصر الكيميائية الأخرى في هذه المجموعة تحتوي على ذرات ذات غلاف تكافؤ من نفس النوع (ns)1). ولذلك، وبسبب طبقة التكافؤ المماثلة، كان من الممكن إنتاج الهيدروجين في هذا الشكل المعدني.
مصادر:
دو كانتو، إي. لام. لايت، ل. ل. دبليو؛ كانتو، ل. دبليو. الكيمياء – في الحياة اليومية. 1. إد. ساو باولو: موديرنا، 2021.
أتكينز، ب. جونز، ل.؛ لافيرمان، ل. مبادئ الكيمياء: التشكيك في الحياة والبيئة. 7. إد. بورتو أليغري: بوكمان، 2018.
أتكينز، ب. دي باولا، J .؛ كيلر، ج. أتكينز الكيمياء الفيزيائية. 11 إد. أكسفورد: مطبعة جامعة أكسفورد، 2018.
هل ترغب في الإشارة إلى هذا النص في العمل المدرسي أو الأكاديمي؟ ينظر:
نوفيس، ستيفانو أراوجو. "الغلاف الكهربائي"؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/eletrosfera.htm. تم الوصول إليه في 10 نوفمبر 2023.


