يمكننا أن نلاحظ ذلك عندما نزيد تركيز واحد أو كل المواد المتفاعلة المشاركة في تفاعل كيميائي ، هناك زيادة في معدل تطوره ، أي سرعة التفاعل.
والعكس صحيح أيضا. على سبيل المثال ، يوصى حاليًا باستخدام هلام الكحول بدلاً من الكحول العادي ، حيث تقل مخاطر الاحتراق وبالتالي تجنب الحوادث. الكحول السائل العادي هو في الواقع مزيج من الكحول والماء ، مع كحول هلامي يحتوي على كمية أقل من الكحول. لذلك ، عندما ينخفض تركيز أحد متفاعلات الاحتراق ، في حالة الكحول ، يستمر التفاعل بشكل أبطأ. من ناحية أخرى ، كلما كان الكحول أنقى ، زادت سرعة تفاعل الاحتراق.

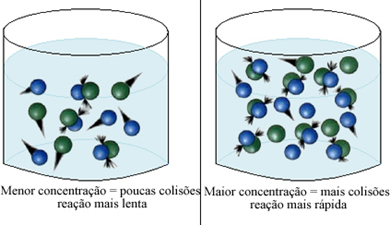
كما جاء في النص شروط حدوث التفاعلات الكيميائية، أحد شروط حدوث رد الفعل هو تصادم فعال بين الجسيمات. هكذا، تجعل الزيادة في تركيز الكواشف من الممكن وجود كمية أكبر من الجسيمات أو الجزيئات المحصورة في نفس المكان. هذا يزيد من مقدار الاصطدامات بينهم ويزيد أيضًا من احتمالية حدوث تصادمات فعالة تؤدي إلى حدوث رد فعل. والنتيجة هي أن التفاعل يحدث بشكل أسرع.
لرؤية هذا ، فكر في المثال التالي: عندما يكون لدينا جمرة مشتعلة ونريد أن تتم معالجة هذا الاحتراق بشكل أسرع ، هل نقوم بنفخ أو تهوية العضو؟ لماذا هذا العمل؟
حسنًا ، أحد المواد المتفاعلة في تفاعل الاحتراق هذا هو الأكسجين الموجود في الهواء. عندما نهتز ، فإن تيار الهواء يزيل الرماد الذي يتشكل أثناء الاحتراق وهذا يسهل اتصال الأكسجين مع الجمرة. بهذه الطريقة ، نزيد من الاتصال بين المواد المتفاعلة ونسرّع تفاعل الاحتراق.
باختصار ، لدينا:

عند العمل مع الغازات ، فإن إحدى الطرق لزيادة تركيز المواد المتفاعلة هي خفض الضغط. عندما نقوم بذلك ، فإننا نخفض الحجم ، وبالتالي هناك زيادة في تركيزات الكاشف.

بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm