ال الذوبان ، أو معامل الذوبان ، إنها خاصية مادية للمادة يتم تحديدها دائمًا عمليًا في المختبر. إنه مرتبط بالقدرة التي تسمى المادة المذاب، يعرض ليتم حلها من قبل شخص آخر ، مذيب.
بالنسبة للذوبان ، يمكن تصنيف المواد المذابة على النحو التالي:
قابل للذوبان: تلك التي تذوب في المذيب. كلوريد الصوديوم (المذاب) ، على سبيل المثال ، قابل للذوبان في الماء (مذيب) ؛
قابل للذوبان قليلا: أولئك الذين يجدون صعوبة في الذوبان في المذيب. هذه هي حالة هيدروكسيد الكالسيوم [Ca (OH)2] (المذاب) في الماء ؛
غير قابلة للذوبان: تلك لا تذوب في المذيب. الرمل (المذاب) ، على سبيل المثال ، غير قابل للذوبان في الماء.
ال الذوبان يرتبط جدًا بإعداد حلول (مخاليط متجانسة) ، لأنه من أجل الحصول على حل ، من الضروري أن يكون المذاب المستخدم قابل للذوبان في المذيب.
العوامل المؤثرة على الذوبان
حتى عندما يكون المذاب قابلًا للذوبان في المذيب ، فهناك بعض العوامل التي يمكن أن تؤثر على قدرة المذاب على الذوبان. هل هم:
أ) العلاقة بين كمية المذاب والمذيب
يحتوي المذيب دائمًا على حدود للذوبان يمكن أن يذوب. إذا قمنا بزيادة كمية المذيب مع الحفاظ على كمية المذاب ، فإن المذيب يميل إلى إذابة كل المذاب المستخدم.
ب) درجة حرارة
درجة الحرارة هي العامل المادي الوحيد القادر على تعديل قابلية ذوبان المذيب فيما يتعلق بمذاب معين. يعتمد هذا التعديل على طبيعة المذاب ، كما سنرى أدناه:
المذاب الماص للحرارة: هو الذي ننجح في إذابة كتلة أكبر ، طالما أن درجة حرارة المذيب أعلى من درجة حرارة الغرفة. كلما زادت سخونة المذيب ، كلما زاد الذوبان.
مثال: من الممكن إذابة كمية أكبر من البن المطحون عندما يكون الماء ساخنًا.
المذاب الطارد للحرارة: هو الذي ننجح في إذابة كتلة أكبر ، طالما أن درجة حرارة المذيب أقل من درجة حرارة الغرفة. كلما كان المذيب أكثر برودة ، كلما زاد الذوبان.
مثال: من الممكن إذابة كمية أكبر من ثاني أكسيد الكربون عندما تكون الصودا باردة.
طرق لتحديد الذوبان
نظرًا لأن القابلية للذوبان هي خاصية تم تحديدها بطريقة تجريبية ، فقد تم بالفعل تقييم قابلية الذوبان الخاصة بها في معظم المذيبات المختلفة. وبالتالي ، يمكننا الوصول إلى قابلية الذوبان في مذيب معين على النحو التالي:
أ) تحليل الجدول
في كثير من الأحيان ، يمكن للطالب أن يصادف قابلية الذوبان من تفسير الجدول. انظر المثال التالي:
مثال: (UEPG - مقتبس) يوضح الجدول أدناه قابلية ذوبان ملح Li2كو3 في 100 جرام من الماء.

يعرض الجدول قيم الكتلة بالجرام من Li2كو3 التي يمكن إذابتها في 100 جرام من الماء ، من 0 اC إلى 50 اج. يمكننا أن نرى أنه كلما زادت حرارة الماء ، قل لي2كو3 يذوب. لذلك ، لي2كو3 إنه مذاب طارد للحرارة (سوف يذوب أكثر إذا كان الماء باردًا).
ب) تحليل الرسم البياني
يمكن تقييم الذوبان من خلال تفسير الرسم البياني. للقيام بذلك ، ما عليك سوى تحديد درجة الحرارة ، وتحويلها إلى المنحنى ثم تحويل المنحنى إلى المحور y ، وهو الكتلة بالجرام من المذاب التي سيتم إذابتها.
مثال: (UFTM - مقتبس) يوضح الرسم البياني منحنى قابلية الذوبان لملح AX2.
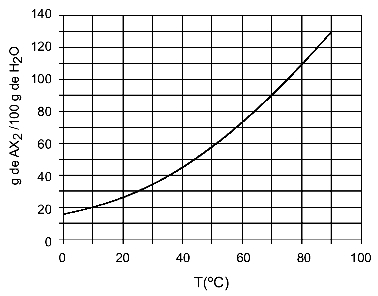
يوضح الرسم البياني أن كمية الماء (المذيب) على المحور y تساوي 100 جرام. للمذاب AX2نحدد كمية الماء في درجات الحرارة التالية:
30اج: عندما نقوم بتشغيل درجة الحرارة 30اC للمنحنى ثم المنحنى إلى المحور y ، لدينا أنه عند درجة الحرارة هذه ، يمكن لـ 100 جرام من الماء إذابة ما يقرب من 35 جرامًا من المذاب AX2.
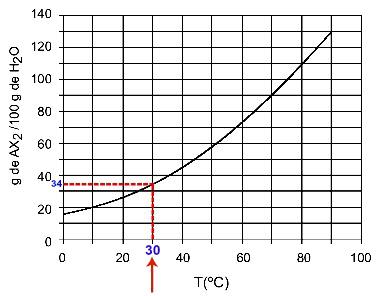
تحديد قابلية الذوبان AX2 في 30اج
40اج: عندما نقوم بتشغيل درجة الحرارة 40اC للمنحنى ثم المنحنى إلى المحور y ، لدينا أنه عند درجة الحرارة هذه ، يمكن لـ 100 جرام من الماء إذابة حوالي 45 جرامًا من المذاب AX2.
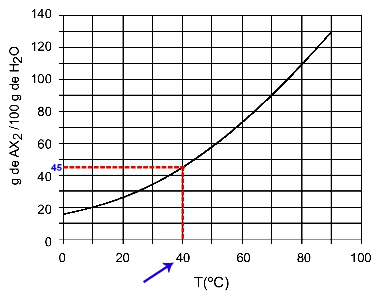
تحديد قابلية الذوبان AX2 في 40اج
نظرًا لأن كمية المذاب المذاب تكون أكبر مع كل زيادة في درجة الحرارة ، فلدينا هذا AX2 إنه مذاب ماص للحرارة.
ج) التفسير النصي
انظر المثال التالي:
مثال: (PUC-MG) بعض المواد قادرة على تكوين مخاليط متجانسة مع مواد أخرى. تسمى المادة التي تحتوي على أكبر كمية مذيب وتسمى المادة الأقل كمية مادة مذابة. يشكل كلوريد الصوديوم (NaCl) محلولًا متجانسًا مع الماء ، حيث يمكن إذابة 36 جم من NaCl في 100 جم من الماء عند درجة حرارة 20 درجة مئوية.
ينص النص على أنه إذا كان لدينا 100 جرام من الماء (مذيب) ، عند درجة حرارة 20 اC ، من الممكن إذابة ما يصل إلى 36 جرامًا من NaCl.
بي ديوغو لوبيز دياس
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-solubilidade.htm


