أنت الصابون و ال المنظفات تستخدم لإزالة الأوساخ وخاصة الشحوم من المواد. لكن ما الفرق بين الاثنين؟ هل هناك فائدة أكبر من استخدام الصابون أو المنظفات؟ ماذا عن البيئة؟ التي تلوث أقل؟
دعونا نلقي نظرة على هيكل كل واحد ، للوصول إلى إجابة مرضية.
الصابون له الهيكل النموذجي التالي:
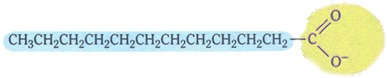
هيكل نموذجي للصابون.
لاحظ أنه يحتوي على جزء غير قطبي ، يمثله اللون الأزرق ، والذي يتفاعل مع الدهون والزيت ، وهما أيضًا غير قطبيين ؛ وله جزء قطبي (باللون الأصفر) يتفاعل مع الماء.
يحتوي هيكل المنظفات أيضًا على جزء قطبي وجزء غير قطبي ، كما يتضح أدناه:
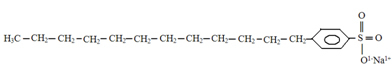
التركيب النموذجي للمنظفات.
النقطة التي نريد لفت الانتباه إليها ، والتي يمكن ملاحظتها من خلال مقارنة الهيكلين ، هي أن المنظفات الأكثر شيوعًا هي أملاح مشتقة من حامض الكبريتيك (H2فقط4)، وهو حمض قوي ويسبب المزيد من الضرر للبيئة. لذلك ، يوجد الكبريت (S) في هيكل المنظف. المادة الخام الأساسية للمنظفات هي البترول، وهو مصدر للطاقة الأحفورية غير المتجددة.
بالإضافة إلى ذلك ، الحالة الموضحة أعلاه عبارة عن منظف قابل للتحلل البيولوجي ، ولكن هناك بعض المنظفات التي لها تشعبات في هيكلها ، والتي لا تتحلل بيولوجيًا ، أو أي أنها لا تتحلل بفعل الكائنات الحية الدقيقة وإذا تم إغراقها في الأنهار والبحيرات يمكن أن تتسبب في آثار بيئية خطيرة مع ما يترتب على ذلك من موت مختلف الأسماك والطحالب والحشرات والطيور مائي.
يصنع الصابون من زيوت أو دهون تتفاعل مع قاعدة قوية مثل هيدروكسيد الصوديوم (هيدروكسيد الصوديوم). حتى الصابون أملاح حمض الكربوكسيل، وهي أحماض ضعيفة. في تركيب هذه الصابون ، يتم استبدال هيدروجين المجموعة الكربوكسيلية (─COOH) بأيونات الصوديوم (Na+) والبوتاسيوم (K.+) أو الأمونيوم (NH4+)، كما هو مبين أدناه. والنتيجة هي أن جميع أنواع الصابون قابلة للتحلل.
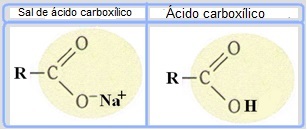
الصابون هو أملاح الأحماض الكربوكسيلية التي يتم فيها استبدال الهيدروجين الموجود في الحمض بكاتيون.
الجانب السلبي الآخر للمنظفات هو احتوائها على الكثير منها أيونات الفوسفات في هيكلها. تستخدم الطحالب هذه الأيونات كمغذيات ، لذلك يتم التخلص من هذه المنظفات في الأنهار ، تتزايد أيونات الفوسفات الخاصة بها بشكل كبير وتتضاعف هذه الطحالب بأعداد كبيرة. مقياس. هذه العملية تسمى التخثث ويسبب موت الأسماك وغيرها من الكائنات الحية المائية ، حيث ستغطي الطحالب أسطح البحيرات ، مما يمنع دخول الضوء والأكسجين إلى الماء.
هكذا، إذا نظرنا إلى القضية البيئية ، فإن قطع الصابون هو الخيار الأفضل.

يطلق على تكاثر الطحالب المفرط التخثث.
لكن ماذا عن الكفاءة؟
حسنًا ، الصابون له عيب عندما يتم التنظيف بالماء الذي يحتوي على الكالسيوم والمغنيسيوم وكاتيونات الحديد ، مثل يمكن للأنيونات الموجودة في الصابون أن تتفاعل مع هذه الكاتيونات ، مما ينتج مركبات غير قابلة للذوبان ، والتي تترسب وتشكل ما يسمى بالماء. الصعب. نتيجة لذلك ، لا يمكن للصابون إزالة الأوساخ والشحوم.
من ناحية أخرى ، تتمتع المنظفات بميزة على الصابون لأنها لا تتفاعل أبدًا مع الكاتيونات الموجودة في الماء العسر وبالتالي فهي نظيفة بغض النظر عن الماء المستخدم.
جينيفر فوغاكا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/sabao-x-detergente.htm


