التأين هي الظاهرة الكيميائية التي تؤدي فيها المادة الحمضية (صيغتها العامة HX) ، عند إذابتها في الماء ، إلى ظهور أيونين: كاتيون الهيدرونيوم (H3ا+ أو H.+) وأي أنيون (X-). يتم تمثيل الظاهرة من معادلة. نظرة:
HX + H.2O → H.3ا+ + X-
أثناء التأين ، فقط الهيدروجين المؤين من حامض يتم تحويلها إلى كاتيونات الهيدرونيوم ، وهو عامل يعتمد أيضًا على قدرة تأين هذا الحمض ، أي على درجة التأين (α). وبالتالي ، ليس كل الهيدروجين يشكل الهيدرونيوم ، ما لم يكن للحمض درجة من التأين تساوي 100٪.
ومع ذلك ، عندما نكون كذلك بناء معادلة التأين ، نحن لا نأخذ بعين الاعتبار درجة تأين الحمض بل كمية الهيدروجين المؤين الذي يقدمه.
كقاعدة عامة ، نعتبر أن الهيدروجين القابل للتأين هو كل الهيدروجين الموجود في الهيدروجين. في حالة الأكسجين ، فإن الهيدروجين المرتبط بذرات الكربون فقط هو القابل للتأين ، كما يتضح من الصيغة البنائية الموضحة أدناه:
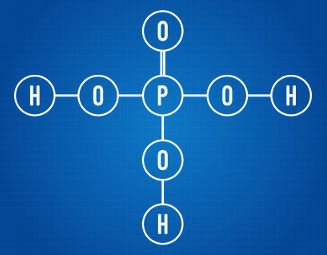
يحتوي حمض الفوسفوريك على ثلاثة هيدروجين مؤين
بتحليل الصيغة البنائية أعلاه ، يمكننا أن نرى أن الحمض المعني به ثلاث ذرات هيدروجين مرتبطة بذرات الأكسجين. على هذا النحو ، لديه ما مجموعه ثلاثة هيدروجين مؤين.
انظر بعض أمثلة التجميع معادلة التأين لبعض الأحماض:
مثال 1: حمض الهيدروبروميك (HBr)
HBr + H2O → H.3ا+ + ر-
حمض الهيدروبروميك هو هيدروجين يحتوي على هيدروجين واحد فقط في تركيبته. نظرًا لأنه يمكن تأين كل الهيدروجين في الهيدروجين ، فإنه يتشكل عندما يذوب في الماء فقط مول واحد من كاتيون الهيدرونيوم انها ال أنيون بروميد (Br-).
المثال 2: كبريتيد الهيدروجين (H2س)
ح2Y + 2 ح2O → 2 ح+ + S.-2
كبريتيد الهيدروجين هو هيدروجين يحتوي على اثنين من الهيدروجين في تركيبته. بما أنه يمكن تأين كل الهيدروجين الموجود في الهيدراكيد ، فإنه يتشكل عندما يذوب في الماء اثنين من المولات الكاتيونات الهيدرونيوم انها ال أنيون كبريتيد (S.-2). لهذا استخدمنا اثنين من مولات الماء.
المثال 3: حمض المنجانيك (H2MnO4)
ح2MnO4 + 2 ح2O → 2 ح3ا+ + MnO4-2
حمض المنغانيك هو أكسجين يحتوي على اثنين من الهيدروجين في تركيبته. كما هو الحال في الأوكسجين ، فإن الهيدروجين المرتبط بالأكسجين فقط هو قابل للتأين - في حالة حمض المنجانيك ، الهيدروجين - ، سيتشكل ، عندما يذوب في الماء ، اثنين من المولات الكاتيونات الهيدرونيوم انها ال أنيون المنغنات (MnO4-2). لهذا استخدمنا اثنين من مولات الماء.
المثال 4: حمض الفوسفور (H3غبار3)
ح3غبار3 + 2 ح2O → 2 ح3ا+ + HPO3-2
حمض الفوسفور هو أكسجين يحتوي على ثلاثة هيدروجين في تركيبته. كما هو الحال في الأوكسجين ، فإن الهيدروجين المرتبط بالأكسجين فقط هو قابل للتأين - في حالة حمض الفوسفور ، يكون الهيدروجين - ، سيتشكل ، عند الذوبان في الماء ، اثنين من المولات الكاتيونات الهيدرونيوم انها ال أنيون الفوسفيت (HPO3-2). لهذا استخدمنا اثنين من مولات الماء.
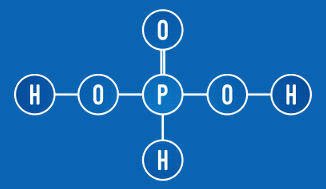
يحتوي حمض الفوسفور على نوعين من الهيدروجين المتأين (مجموعة OH)
المثال 5: حمض البوريك (H3بو3)
ح3بو3 + 3 ح2O → 3 ح+ + بو3-3
حمض البوريك هو أكسجين يحتوي على ثلاثة هيدروجين في تركيبته. كما هو الحال في الأوكسجين ، فإن الهيدروجين المرتبط بالأكسجين فقط قابل للتأين - في حالة حمض البوريك ، الهيدروجين الثلاثة - ، سوف يتشكل ، عند الذوبان في الماء ، ثلاث مولات من كاتيونات الهيدرونيوم انها ال أنيون بورات (BO3-3). لهذا استخدمنا ثلاث مولات من الماء.
المثال 6: حمض البيروفوسفوريك (H4ص2ا7)
ح4ص2ا7 + 4 ح2O → 4 ح3ا+ + ص2ا7-4
حمض البيروفوسفوريك هو أكسجين يحتوي على أربعة هيدروجين في تركيبته. كما هو الحال في الأوكسجين ، فإن الهيدروجين المرتبط بالأكسجين فقط قابل للتأين - في حالة حمض البوريك ، الهيدروجين الأربعة - ، سوف يتشكل ، عند الذوبان في الماء ، أربعة مولات من كاتيونات الهيدرونيوم انها ال أنيونبيروفوسفات (ص2ا7-4). لهذا استخدمنا أربعة مولات من الماء.
بي ديوغو لوبيز دياس
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/equacoes-ionizacao-dos-acidos.htm

