عندما يتم تسخين مادة ما ، فإنها تتلقى الطاقة بطريقة تهيج جزيئاتها ، وتبدأ في شغل حجم أكبر ، أي أنها تخضع للتوسع. يحدث العكس عندما يتم تبريد مادة ما ، حيث تفقد الطاقة وتميل جزيئاتها إلى أن تكون قريبة جدًا من بعضها ، مما يؤدي إلى تقلص الحجم. يؤدي هذا عادةً إلى احتلال المادة في الحالة الصلبة حجمًا أقل مما كانت عليه في الحالة السائلة.
على عكس ما يحدث مع معظم المواد ، فإن الماء له سلوك شاذ: فعند تسخينه ، بين فترتي 0 و 4 درجات مئوية ، فإنه يعاني الانكماش ثم يبدأ في التمدد ، أي عندما يكون الماء في حالته الصلبة ، يكون حجمه أكبر مما هو عليه في الحالة السائلة في هذه الفترة من درجة الحرارة. يمكن تمثيل هذا السلوك المائي غير المنتظم بالرسم البياني التالي:
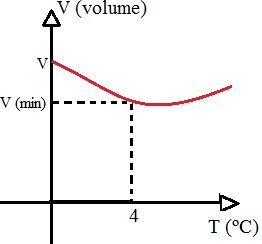
ينخفض حجم الماء بين 0 و 4 درجات مئوية ثم يبدأ في الزيادة
إذا انخفض حجم الماء خلال هذه الفترة وظلت كتلته ثابتة ، وبالتالي فإن كثافة من الماء ، وهي النسبة بين الكتلة والحجم ، سيكون الحد الأقصى عندما يكون الماء عند 4 درجات مئوية. انظر إلى الرسم البياني:
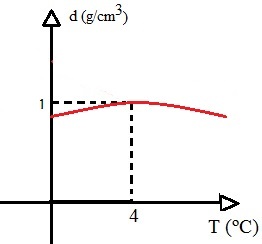
يوضح هذا الرسم البياني أن كثافة الماء تكون قصوى عندما تكون درجة الحرارة 4 درجات مئوية
ولكن ما هو سبب هذا التمدد الشاذ
من الماء? تم العثور على هذا التفسير في تركيبتها الجزيئية. ترتبط جزيئات الماء من خلال روابط كيميائية تسمى روابط هيدروجينية.عندما ترتفع درجة حرارة الماء ، فوق 0 درجة مئوية ، تبدأ الروابط الهيدروجينية في الانكسار ، مما يتسبب في تقريب بين الجزيئات. يتغلب هذا التأثير على التحريض الحراري الجزيئي ، الذي يتسبب في تباعد الجزيئات وجعلها تشغل حجمًا أكبر بحيث يتقلص حجمها.
عندما تتجاوز درجة الحرارة 4 درجات مئوية ، يكون عدد الروابط الهيدروجينية منخفضًا جدًا بالفعل. بهذه الطريقة ، يبدأ التباعد الجزيئي في السيادة ، وبالتالي زيادة في حجمه.
يفسر هذا السلوك المائي غير المنتظم العديد من الظواهر الطبيعية ، بما في ذلك حقيقة أن الجليد يطفو على الماء ، وهو ما يحدث في المناطق شديدة البرودة ، حيث يتجمد سطح البحيرات بينما تبقى المياه في القاع سائل. نظرًا لأن الماء له كثافة قصوى عند 4 درجات مئوية ، فإنه يظل في القاع ، مما يجعل الحمل الحراري ، وهو a التبادل الحراري بسبب الاختلاف في الكثافة.
بقلم ماريان مينديز
تخرج في الفيزياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/fisica/a-agua-seu-comportamento-irregula.htm

