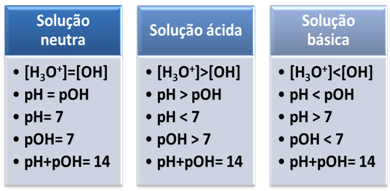
يعتبر الوسيط محايدًا إذا كان له نفس التركيز ، بالمول / لتر ، لأيونات الهيدرونيوم (H3ا+) وهيدروكسيد (OH-).
مثال على وسيط محايد يعمل حتى كمعيار للحلول الأخرى هو الماء المقطر النقي عند درجة حرارة 25 درجة مئوية. عند درجة الحرارة هذه ، يكون لها بالضبط 1. 10-7 مول / لتر لكلا الأيونات. ومن ثم ، فإن منتجك الأيوني (K.ث) يساوي 10-14 (مول / لتر)2:
كث = [ح3ا+]. [أوه-]
كث = (1. 10-7 مول / لتر). (1. 10-7 مول / لتر) = 10-14 (مول / لتر)2
يتم إعطاء الأس الهيدروجيني و الأس الهيدروجيني أدناه:
الرقم الهيدروجيني = - سجل [H.3ا+] pOH = -log [OH-]
الرقم الهيدروجيني = - سجل 1. 10-7 pOH = - سجل 1. 10-7
الرقم الهيدروجيني = 7pOH = 7
هذا يوضح لنا أنه في حل محايد ، فإن الرقم الهيدروجيني يساوي pOH.
- وسط حمضي:
في وسط حمضي ، تركيز H أيونات3ا+ أكبر من أيونات OH-.
يمكن تحقيق هذا الحل عن طريق إضافة جزء صغير من H أيونات3ا+، على سبيل المثال ، عن طريق حمض.
وفقًا لمبدأ Le Chatelier ، عندما يحدث اضطراب في نظام في حالة توازن ، فإنه يميل إلى إعادة ضبط نفسه من أجل تقليل تأثيرات هذه القوة. هذا يعني أنه إذا تمت إضافة حمض إلى الماء ، فإن H أيونات
3ا+ ستكون زائدة وسيتحول الرصيد في اتجاه رد الفعل العكسي إلى اليسار. لذلك سوف تتفاعل هذه الأيونات الزائدة مع أيونات OH-. وهكذا ، فإن تركيز أيونات OH- سوف ينخفض ويصبح المحلول حامضيًا.
المنتج الأيوني (Kw) يساوي دائمًا 10-14، ولكن تركيز H أيونات3ا+ أكبر من تركيز أيونات OH-1. لذلك ، يكون الرقم الهيدروجيني أكبر من الأس الهيدروجيني في وسط حمضي ، لكن مجموعه دائمًا يساوي 14.
أيضًا ، كلما زاد تركيز H أيونات3ا+، زادت قيمة الرقم الهيدروجيني. في درجة حرارة الغرفة (25 درجة مئوية) ، ودرجة الحموضة <7 و pOH> 7.

- الوسائل الأساسية:
في الوسط الأساسي ، تركيز أيونات OH- أكبر من H أيونات3ا+.
إذا أضفنا قاعدة إلى الماء ، فهذا يعني أننا نضيف أيونات OH.- وكما أوضحنا في البند السابق ، من خلال مبدأ Le Chatelier ، توازن رد فعل سيتحرك التأين الذاتي للماء في الاتجاه المعاكس ، مع تفاعل الأيونات الزائدة معه H أيونات3ا+، مما يقلل من تركيزك ويجعل الحل أساسيًا.
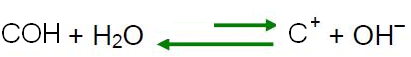
في هذه الحالة ، سيكون الأس الهيدروجيني أكبر من الرقم الهيدروجيني. في درجة حرارة الغرفة (25 درجة مئوية) ، ودرجة الحموضة> 7 و pOH <7.

موجز:
بقلم جينيفر فوغاسا
تخرج في الكيمياء

