ال المعايرة هو إجراء مخبري يستخدم لتحديد التركيز في كمية المادة (أو التركيز بالمول / لتر) من محلول يحتوي على حمض أو قاعدة.
أثناء المعايرة ، هناك دائمًا ملف خليط من المحاليل المحتوية على مواد مذابة مختلفة مع حدوث تفاعل كيميائي. نظرًا لأن المحاليل المختلطة تحتوي دائمًا على حمض وقاعدة ، فإن التفاعل الكيميائي الذي يحدث هو أ تحييد.
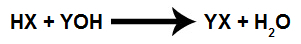
معادلة كيميائية تمثل المعايرة.
أثناء عملية تحديد التركيز المولي لمحلول غير معروف المعايرة يعتمد على العوامل التالية:
• معرفة التركيز المولي للمحلول الذي سيتم مزجه مع المجهول.
• معرفة حجم المحلول مجهول التركيز.
• معرفة حجم المحلول للتركيز المعروف.
الصيغة المستخدمة في المعايرة
و في المعايرة يحدث التعادل (عدد متساوٍ من مولات الحمض والقاعدة) ، يمكننا استخدام الصيغة التالية لتحديد التركيز المولي للمحلول غير المعروف:
لاال = نب
مال.الخامسال = مب.الخامسب
ملحوظة: عدد المولات هو الناتج بين التركيز المولي (M) وحجم المحلول (V).
المعدات اللازمة لأداء درجة
• Burette: جهاز يستخدم لقياس حجم المحلول ذي التركيز المعروف.

• إرلنماير Erlenmeyer: المعدات المستخدمة لتلقي المحلول المجهول التركيز.
• الدعم الشامل: المعدات التي يتم تثبيت المخلب عليها ؛

• المخلب: المعدات المستخدمة لحمل السحاحة.

• محرك مغناطيسي: معدات تستخدم لتحريك المحلول الموجود في دورق المخروطي.

خطوات الدرجة
-
المرحلة الأولى: تثبيت السحاحة على الدعم الشامل باستخدام المخلب ؛
-
المرحلة الثانية: ضع دورق مخروطي على المحرك المغناطيسي ؛
-
المرحلة الثالثة: إضافة حجم معين ، داخل دورق إرلنماير ، من محلول مجهول التركيز. على سبيل المثال: أضف 10 مل من المحلول إلى دورق Erlenmeyer ؛
- المرحلة الرابعة: أضف الفينول فثالين إلى المحلول الموجود في دورق إرلنماير.
ملاحظة: إذا كان المحلول الموجود في دورق إرلنماير حمضيًا ، عند إضافة الفينول فثالين ، فإن المحلول سيبقى اللون دون تغيير ، ومع ذلك ، إذا كان الحل أساسيًا ، فسيكون ورديًا ضارب الى الحمرة.

يضاف الفينول فثالين إلى محلول مميز أساسي.
-
المرحلة الخامسة: أضف شريطًا مغناطيسيًا داخل دورق مخروطي. ثم قم بتشغيل المحرك المغناطيسي بحيث يتم تقليب السائل الموجود داخل Erlenmeyer ؛
-
المرحلة السادسة: أضف داخل السحاحة ، حتى سعتها القصوى ، حجم محلول بتركيز معروف ، أي إذا كانت السحاحة 50 مل ، أضف 50 مل من هذا المحلول.
- الخطوة السابعة: افتح صمام السحاحة واترك السائل من الداخل يسقط في دورق مخروطي.
الملاحظات التي تمت أثناء المعايرة
بمجرد فتح السحاحة على دورق Erlenmeyer ، يبدأ تفاعل التعادل ، أي أن الحمض يتفاعل مع القاعدة ، مكونًا الملح والماء تدريجيًا.
عندما يحدث تفاعل المعادلة مع الخليط ، فإن لون المحلول الموجود في يتغير إرلنماير أيضًا بشكل تدريجي ، ما نسميه نقطة التحول ، على النحو التالي:
- إذا كان عديم اللون ، يبدأ في الظهور زهريضارب الى الحمرة,
- إذا كانتزهريضارب الى الحمرة، يبدأ في التحول إلى عديم اللون.
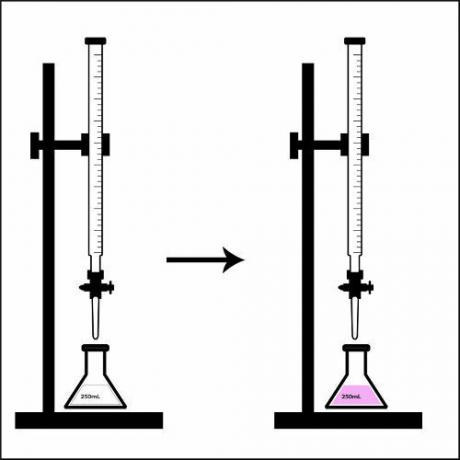
تمثيل نقطة التحول في المعايرة بالتحليل الحجمي.
عندما يتغير لون المحلول الموجود في دورق المخروطي تمامًا ، أي أنه وصل إلى نقطة التحول ، نقول إن المعايرة قد انتهت. في تلك اللحظة ، تحقق فقط من الحجم المستخدم لمحلول التركيز المعروف الموجود على السحاحة.
من المجموع بين حجم المحلول للتركيز المعروف ، والذي تم تحديده في السحاحة ، و حجم المحلول المجهول ، والذي كان دورق مخروطي ، نحن في وضع يسمح لنا بتحديد تركيزه الضرس.
بي ديوغو لوبيز دياس
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-titulacao.htm