السمة المميزة الرئيسية لتفاعلات الأكسدة والاختزال هي أن نوعًا كيميائيًا يفقد الإلكترونات (عن طريق الأكسدة) ويفقد نوع آخر الإلكترونات (عن طريق الاختزال).
ومع ذلك ، في تفاعلات معينة ، من الممكن ملاحظة أنه لا يوجد فقط أكسدة و / أو اختزال. فيما يلي مثال:
SnS + حمض الهيدروكلوريك + HNO3 → SnCl4 + S + لا + ح2ا
بحساب عدد الأكسدة (Nox) لجميع الذرات في هذا التفاعل ، كما هو موضح في نص "تحديد عدد الأكسدة (Nox)" ، لدينا:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + حمض الهيدروكلوريك + HNO3 → SnCl4 + S + لا + ح2ا
دعنا نتحقق الآن من أي منهاعانت المواد من اختلافات في أكاسيد النيتروجين ، وبالتالي تتأكسد وتنخفض:
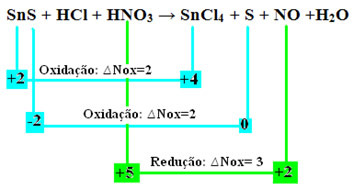
لاحظ حدوث اثنين من الأكسدة. إذن ، في هذه الحالة ، كيف نوازن المعادلة الكيميائية؟
أحد الأشياء المهمة التي يجب مراعاتها والتي تنطبق على جميع تفاعلات الأكسدة والاختزال هي ذلك يجب أن يساوي عدد الإلكترونات المعطاة دائمًا عدد الإلكترونات المستلمة.
لذلك ، لتحقيق التوازن بين هذا النوع من ردود الفعل ، اتبع نفس القواعد المنصوص عليها في النص "موازنة الأكسدة والاختزال"، مع تغيير واحد فقط: سيكون تحديد اختلاف Nox (∆Nox) للأنواع التي تولدت التأكسدين (SnS) هو مجموع اثنين ∆Nox ، والذي سيعطينا القيمة الإجمالية للإلكترونات المفقودة:
- SnS: ∆Total Nox = (∆Nox SnCl4) + (∆Nox S)
SnS: إجمالي أكاسيد النيتروجين = 2 + 2 = 4
- HNO3: ∆Nox = 3
لذلك ، يمكننا المضي قدمًا في الخطوات التالية للموازنة:
- SnS: إجمالي أكاسيد النيتروجين = 4 → 4 سيكون معامل HNO3;
- HNO3: ∆Nox = 3 → 3 سيكون معامل SnS.
3 SnS + HCl + 4 HNO3 → SnCl4 + S + لا + ح2ا
استمرار التوازن عن طريق الطريقة التجريبية:
- نظرًا لأن لديك 3 Sn و 3 S في العضو الأول ، فستكون هذه أيضًا معاملاتك في العضو الثاني:
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 نعم + لا + ح2ا
- مع ذلك ، تم ترك العضو الثاني بـ 12 سل (3. 4 = 12) ، لذلك سيكون 12 هو معامل المادة التي يوجد فيها Cl في العضو الأول ، وهو HCl:
3 SNS + 12 حمض الهيدروكلوريك + 4 HNO3 → 3 SnCl4 + 3 S + لا + ح2ا
- لدينا الآن 16 H في العضو الأول (12 + 4 = 16) ، ومن هنا جاء معامل H2سيكون O يساوي 8 ، لأن 8 في مؤشر الهيدروجين ، وهو 2 ، نحصل على 16:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + لا +8ح2ا
- علاوة على ذلك ، في العضو الأول يوجد أيضًا 4 N ، لذلك سيكون 4 أيضًا معامل N في العضو الثاني:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 4 لا +8 ساعة2ا
لاحظ أن كمية الأكسجين في الطرف الأول (3. 4 = 12) يساوي المبلغ الإجمالي لهذا العنصر في الطرف الثاني (4 + 8 = 12). لذا فإن رد الفعل متوازن.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm
