الصيغة الهيكلية هي المخطط الذي يشير إلى الهيكل ، أي ترتيب الذرات التي تتكون منها العناصر الكيميائية ، وكذلك العلاقة بينها. يمكن تمثيلها بطرق مختلفة: مسطحة أو مكثفة أو إلكترونية.
من بين العوامل التي تحدد الهياكل المستخدمة ، عدد الإلكترونات في غلاف التكافؤ هو أحد هذه العوامل.
صيغة مسطحة
تستخدم الصيغة المسطحة الشرطات لتمثيل الروابط التساهمية ، والتي يمكن أن تكون مفردة أو مزدوجة أو ثلاثية ويتم تمثيلها بالطرق التالية:
- اتصال بسيط (عند مشاركة إلكترونين)
= الرابطة المزدوجة (عند مشاركة 4 إلكترونات)
≡ رابط ثلاثي (عند مشاركة 6 إلكترونات)
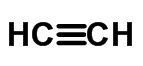
الصيغة المكثفة أو المبسطة
في الصيغة الهيكلية المكثفة ، لا تظهر الروابط.
في تمثيله ، يتم الإشارة إلى عدد ذرات كل عنصر بطريقة مكثفة ، أي مبسطة:
ح3C CH2 إن CH2 CH3
الصيغة الخطية المكثفة
تستخدم الصيغة الخطية المكثفة خطوطًا متعرجة ، يتم تمثيل الكربون عند قممها:
صيغة إلكترونية أو صيغة لويس
يتم تمثيل الصيغة الإلكترونية ، والتي تسمى أيضًا صيغة لويس ، بالنقاط.
من خلال هذه النقاط ، يتم عرض كميات الإلكترونات الموجودة في طبقات التكافؤ:
ح ح
والصيغة الجزيئية؟
ال الصيغة الجزيئية، دون الرجوع إلى هيكلها ، يشير إلى عدد العناصر التي تتكون منها
مركب. بالإضافة إلى بيان عدد الذرات الموجودة في كل عنصر ونسبها.يمكن الحصول عليها من خلال الصيغة الدنيا أو التجريبية والنسبة المئوية أو الصيغة المئوية.
اقرأ أيضا ايزومرية و طبقة فالنسيا.
تمارين محلولة
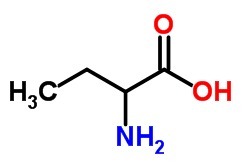
1. (Vunesp-2000) اكتب الصيغة الهيكلية وأدخل الاسم الرسمي:
أ) كيتون سلسلة كربونية متفرعة مشبعة بإجمالي 7 ذرات كربون.
ب) حمض أميني به 4 ذرات كربون.
ال)

ب)
2. (FGV-2005) الأسبارتام هو مُحلي صناعي تم اكتشافه بالصدفة في عام 1965 بواسطة كيميائي مهمل ، قام بلعق أصابعه المتسخة وشعر أنها كانت حلوة.
لا ينصح بهذه العادات غير الصحية ، لأن العديد من المواد بكميات صغيرة شديدة السمية.
الصيغة الهيكلية للأسبارتام موضحة أدناه:

من الصيغة البنائية للأسبارتام ، يبدو أن هناك
أ) 13 ذرة كربون لكل جزيء.
ب) 1 مجموعة وظيفية الأثير.
ج) 1 ثنائي الببتيد
د) 2 ذرات كربون ثالثية
ه) ذرة كربون واحدة غير متماثلة فقط.
البديل ج: 1 ثنائي الببتيد
لمواصلة اختبار معلوماتك ، راجع أيضًا قوائم التمارين هذه:
- تمارين على الهيدروكربونات
- تمارين في الكيمياء العضوية
- تمارين على الايزومرية المسطحة



