تتميز الخلايا أو البطاريات التي تحتوي على الليثيوم كمكون رئيسي لها كواحدة من خصائصها أنها خفيفة جدًا ، حيث أن الليثيوم هو أقل المعادن كثافة التي تم اكتشافها حتى الآن. لإعطائك فكرة ، يطفو هذا المعدن الأبيض الفضي في الماء ، لأنه ضعف كثافته. هذا يرجع إلى حقيقة أن الليثيوم يحتوي فقط على ثلاثة بروتونات وثلاثة نيوترونات.
هناك نوعان رئيسيان من بطاريات الليثيوم ، أحدهما يسمى بطارية الليثيوم اليود. تم تطويره في المقام الأول للاستخدام في أجهزة تنظيم ضربات القلبنظرًا لأنه خفيف جدًا وآمن (لا يطلق الغازات لأنه مغلق بإحكام) ، فإنه يحتوي على سلعة المتانة (حوالي 8 إلى 10 سنوات) ، توفر جهدًا كهربائيًا يبلغ 2.8 فولت وكثافة شحن عالية (0.8 Wh / سم3).
تتكون الأقطاب الكهربائية من الليثيوم ومركب اليود ، تفصل بينهما طبقة بلورية من يوديد الليثيوم تسمح بمرور التيار الكهربائي. ا الليثيوم المعدني يعمل مثل الأنود من هذه الخلية ، أي أن القطب السالب هو الذي يتأكسد ويفقد الإلكترونات. بالفعل الكاثود، القطب الموجب الذي يقلل ، استقبال الإلكترونات ، هو مجمع اليود.
شاهد شبه التفاعلات التي تحدث في الأقطاب الكهربائية والمعادلة التي تمثل التفاعل الشامل لهذا النوع من الخلايا:
تفاعل نصف الأنود: 2 لي(س) → 2 قرأت+(س) + 2 هـ-
شبه رد فعل الكاثود: 1 أنا2 (ق) + 2 هـ-→ 2 أنا-(س)
رد الفعل العالمي: 2 لي(س) + 1 أنا2 (ق) → 2 ليي(س)
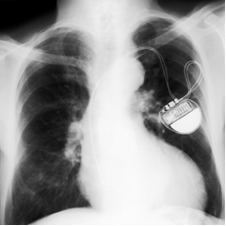
تتشكل بطاريات الليثيوم - اليود مثل العملات المعدنية الصغيرة جدًا ، كما هو موضح في الشكل أدناه:

النوع الآخر من الخلايا أو البطارية هو أيون الليثيوم. يأخذ هذا الاسم بالضبط لأن تشغيله يعتمد على حركة أيونات الليثيوم (Li+). يستخدم حاليا على نطاق واسع في بطاريات الهواتف المحمولة وتتراوح إمكاناته بين 3.0 و 3.5 فولت.

يتكون الأنود والكاثود من ذرات مرتبة في مستويات مثل الصفائح ذات الفراغات حيث يتم إدخال أيونات الليثيوم. ا الأنود يتكون من الجرافيت بمعدن نحاسي ويتم تقطيع الأيونات في مستويات الهياكل الكربونية السداسية ، مكونة المادة التالية: اقرأذج6. بالفعل الكاثود يتكون من أيونات الليثيوم مقحمة في أكسيد بهيكل رقائقي (اقرأxسجع2).
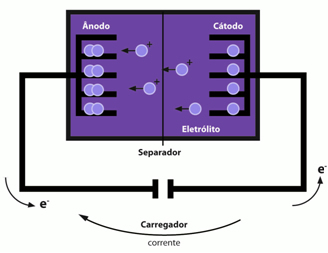
وهكذا ، لدينا أن أيونات الليثيوم تترك الأنود وتهاجر عبر مذيب غير مائي إلى الكاثود.
رد فعل الأنود نصف: Liذج6 (ق) → ذ لي + ج6+ص-
شبه رد فعل الكاثود: Lixسجع2 (ق) + ذ اقرأ+(س) + ذ و- → قرأتس + صسجع2 (ق)
رد فعل عالمي: ليذج6 (ق) + اقرأxسجع2 → ج6(س) +اقرأس + صسجع2 (ق)
هذه البطاريات قابلة لإعادة الشحن ، وذلك ببساطة باستخدام تيار كهربائي خارجي يتسبب في هجرة أيونات الليثيوم في الاتجاه المعاكس ، أي من الأكسيد إلى الجرافيت.

بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/pilhas-baterias-litio.htm

