المذاب والمذيب هما مكونان من خليط متجانس يسمى محلول كيميائي.
- المذاب: هي المادة التي تتشتت في المذيب. إنه يتوافق مع المادة التي سيتم حلها ، وبشكل عام ، تقدم نفسها بكمية أقل في المحلول.
- مذيب: هي المادة التي يذوب فيها المذاب لتشكيل منتج جديد. يقدم نفسه بكمية أكبر في الحل.
يحدث الذوبان بين المذاب (المشتت) والمذيب (المشتت) من خلال التفاعلات بين جزيئاتهم.
الفرق بين هذين المكونين للمحلول هو أن المذاب هو المادة التي ستذوب والمذيب هو المادة التي ستؤثر على الذوبان.
المذيب الأكثر شهرة هو الماء مذيب شامل. هذا لأنه لديه القدرة على إذابة كمية كبيرة من المواد.
أمثلة المذيبات والمذيبات
شاهد بعض الأمثلة على المحاليل الكيميائية واكتشف المذابات والمذيبات لكل منها:
الماء والملح
- المذاب: ملح الطعام - كلوريد الصوديوم (NaCl)
- المذيب: ماء
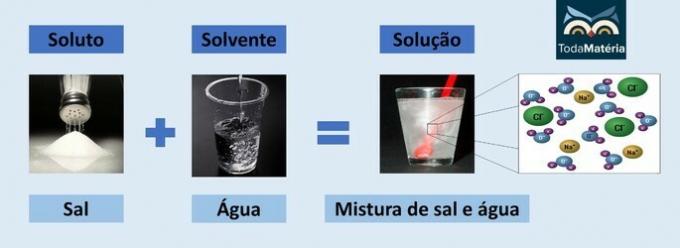
نظرًا لأنه مركب أيوني ، يتفكك كلوريد الصوديوم في المحلول ويشكل أيونات يتم إذابتها بدورها بواسطة جزيئات من ماء.
القطب الموجب للماء (H+) يتفاعل مع أنيون الملح (Cl-) والقطب السالب للماء (O2-) مع الكاتيون (Na+).
هذا نوع من المحاليل الإلكتروليتية ، لأن الأنواع الأيونية في المحلول قادرة على إجراء تيار كهربائي.
الماء والسكر
- المذاب: سكر - سكروز (سي12ح22ا11)
- المذيب: ماء

السكر مركب تساهمي وعندما يذوب في الماء الجزيئات يتفرقون لكن لا يغيرون هويتهم.
يصنف هذا المحلول المائي على أنه غير إلكتروليتي ، حيث أن المادة المذابة المشتتة في المحلول محايدة ، وبالتالي لا تتفاعل مع الماء.
خل
- المذاب: حمض الخليك (CH3COOH)
- المذيب: ماء

الخل عبارة عن محلول يحتوي على 4٪ على الأقل من حمض الأسيتيك ، أ حمض الكربوكسيل التي ، كونها قطبية ، تتفاعل مع الماء ، أيضًا قطبيًا ، من خلال الروابط الهيدروجينية.
قاعدة مهمة للذوبان هي أن مثل يذوب مثل. يتم إذابة المركبات القطبية في مذيبات قطبية ، بينما تذوب المواد غير القطبية في مذيبات غير قطبية.
حلول أخرى
بالإضافة إلى المحاليل السائلة ، توجد أيضًا محاليل غازية وصلبة.
الهواء الذي نتنفسه هو مثال على المحلول الغازي ، غازاته بكميات أكبر هي النيتروجين (78٪) والأكسجين (21٪).
في سبائك معدنية إنها حلول صلبة. على سبيل المثال ، النحاس (الزنك والنحاس) خليط يستخدم لصنع الآلات الموسيقية.
تريد اكتساب المزيد من المعرفة؟ لذا اقرأ هذه النصوص الأخرى:
- حلول كيميائية
- القوى بين الجزيئات
- مخاليط متجانسة وغير متجانسة
ما هو معامل الذوبان؟
معامل الذوبان هو حد المذاب المضاف إلى المذيب عند درجة حرارة معينة لتشكيل محلول مشبع.
ا معامل الذوبان تختلف حسب الظروف ، ويمكن أن تزيد أو تنقص مع التغيرات في درجة الحرارة والمذاب المعني.
هناك حد يمكن للمذيب أن يقوم بحلّه.
مثال: إذا وضعت السكر في كوب من الماء في اللحظة الأولى ستلاحظ أن السكر يختفي في الماء.
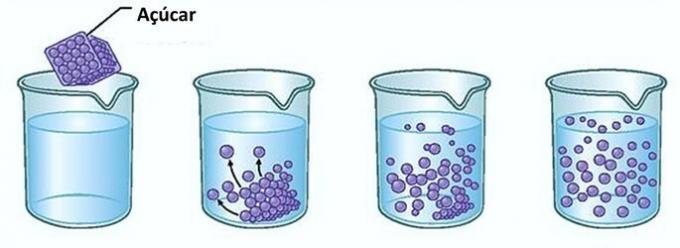
ومع ذلك ، إذا واصلت إضافة السكر ، فستجد أنه في مرحلة ما سيبدأ في التراكم في قاع الكوب.
هذا لأن الماء ، وهو المذيب ، قد وصل إلى حده الأقصى الذوبان وأقصى قدر من التركيز. يسمى المذاب الذي يبقى في قاع الحاوية ولا يذوب الجسم الخلفية.
لن يذوب السكر الزائد في قاع الكوب ولن يؤثر على تركيز المحلول. علاوة على ذلك ، فإن السكر المودع في قاع الكوب لن يجعل الماء أكثر حلاوة.
تصنيف الحلول
يمكن تصنيف المحاليل حسب كمية المذاب المذاب. وبالتالي ، يمكن أن تكون من ثلاثة أنواع: مشبعة وغير مشبعة ومفرطة التشبع.
- محلول مشبع: وصل المحلول إلى حد معامل الذوبان ، أي أن هناك أقصى قدر من المذاب المذاب في المذيب عند درجة حرارة معينة.
- محلول غير مشبع: كمية المذاب الذائب لم تصل بعد إلى معامل الذوبان. هذا يعني أنه يمكن إضافة المزيد من المواد المذابة.
- محلول مفرط التشبع: يوجد مذاب أكثر من الظروف العادية. في هذه الحالة ، يقدمون راسبًا.
لمعرفة المزيد حول الحلول ، اقرأ النصوص التالية.:
- تمييع الحلول
- مولالي
- مولارية
- المعايرة
تركيز الحلول
من المذاب والمذيب يمكن حساب تركيز المحلول.
يُعرَّف التركيز الشائع بأنه نسبة كتلة المذاب المذاب في حجم معين من المحلول.
يتم حساب التركيز باستخدام الصيغة التالية:
يجرى،
ج: التركيز (جم / لتر) ؛
م: كتلة المذاب (g)؛
الخامس: حجم المحلول (L).
مثال:
(Faap) احسب تركيز محلول مائي من نترات الصوديوم بالجرام / لتر يحتوي على 30 جم من الملح في 400 مل من المحلول:
القرار:
لاحظ المعلومات المتعلقة بكميات المذاب والمذيب. يوجد 30 جم من الملح (المذاب) في 400 مل من محلول مائي (مذيب).
ومع ذلك ، الحجم بالملليتر ونحتاج إلى تحويله إلى L:
الآن ، لمعرفة التركيز ، عليك فقط تطبيق الصيغة:
بهذه النتيجة ، توصلنا إلى استنتاج مفاده أنه عندما نخلط 30 جم من الملح مع 400 مل من الماء ، سنحصل على محلول بتركيز 75 جم / لتر.
لمزيد من المعلومات حول كيفية حساب التركيز المشترك ، ستكون هذه النصوص مفيدة.:
- تركيز الحل
- تمارين على التركيز المشترك



