ا أيون يتم تعريفه على أنه ذرة مكهربة اكتسبت أو فقدت الإلكترونات. بالفعل الكاتيون انها ال أنيون تعتبر أيونات.
الكاتيون
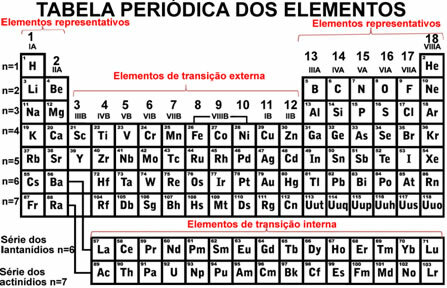
أنت الايونات الموجبة، تتشكل عادة من الفلزات القلوية (عائلة IA) والفلزات القلوية الترابية (عائلة IIA) من الجدول الدوري.
يقدمون شحنة موجبة، لأنها تفقد إلكترونًا واحدًا أو أكثر (التأين) ، مما ينتج عنه عدد أكبر من البروتونات مقارنة بعدد الإلكترونات.
أنواع الكاتيونات
- يتم استدعاء الكاتيونات التي لها شحنة +1 أحادي الإيجاب;
- تسمى الكاتيونات التي لها شحنة +2 الأجهزة;
- تسمى الكاتيونات التي لها شحنة +3 الإيجابيات;
- الكاتيونات التي لها شحنة +4 هي رباعي.
أمثلة على الكاتيونات
- في+1 (صوديوم)
- ك+1 (بوتاسيوم)
- ملغ+2 (المغنيسيوم)
- هنا+2 (كالسيوم)
- Zn+2 (زنك)
- ال+3 (الألومنيوم)
- الرصاص+4 (قيادة)
أنيون
أنت الأنيونات، بدوره شحنة سالبة، حيث يتلقون إلكترونًا واحدًا أو أكثر ، مما ينتج عنه عدد أكبر من الإلكترونات بالنسبة لعدد البروتونات.
أنواع الأنيونات
- الأنيونات أحادي التكافؤ لديها شحنة -1 ؛
- الأنيونات ثنائي التكافؤ لديها -2 تهمة ؛
- الأنيونات ثلاثي التكافؤ لديها -3 تهمة ؛
- الأنيونات رباعي التكافؤ لديك -4 تهمة.
أمثلة على الأنيونات
- Cl-1 (كلور)
- ر-1(بروم)
- F-1(الفلور)
- ا-2 (أكسجين)
- س-2 (كبريت)
- ن-3 (نتروجين)
نظرية الثماني
وفقًا لـ "نظرية الثمانية" ، تميل الذرات إلى الاستقرار والبقاء حيادي (نفس القدر من البروتونات و النيوترونات). هذا هو ، مع ثمانية الإلكترونات في آخر طبقة إلكترونية (طبقة التكافؤ).
لهذا ، تنضم الأيونات مع ذرات أخرى من أجل البحث عن الحياد.
مثال
في الرابطة الأيونية الذي يحدث بين الأيونات الموجبة والسالبة ، Na+1 (الكاتيون) يريد التبرع بإلكترون و Cl-1 (الأنيون) يريد أن يتلقى إلكترونًا.
عندما ترتبط ، فإنها تشكل كلوريد الصوديوم ، NaCl (ملح الطعام).
فضول
مصطلح أيون ، يأتي من "أيون" اليونانية ، ويعني "ما يذهب ، يذهب". وبالمثل ، فإن المصطلحين "أنيون" و "كاتيون" يأتيان من اليونانية ، حيث أنيون تعني "ما يرتفع" والكاتيون "الذي ينخفض".
اقرأ أيضا:
- تمارين على الذرات
- الجدول الدوري
- عائلات الجدول الدوري
- نظرية أرينيوس