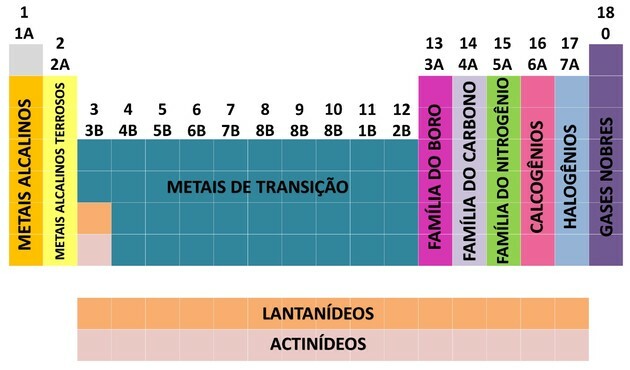
إحدى الطرق التي يتم بها تنظيم العناصر الكيميائية هي من خلال العائلات ، والتي تتوافق مع التسلسلات الرأسية للجدول الدوري.
في 18 عمود من الجدول مجموعة العناصر وفقًا لأوجه التشابه في الخواص الكيميائية.
كان تنظيم العناصر الكيميائية في العائلات طريقة عملية لهيكلة المعلومات المختلفة الموجودة وتقديمها بطريقة بسيطة.
لتسهيل تحديد موقع العنصر الكيميائي ، تم تحديد العائلات بالأرقام من 1 إلى 18 على النحو التالي:
من خلال مساهمة العديد من العلماء والمحاولات المختلفة لترتيب البيانات ، تطور الجدول الدوري ، وإنشاء ترتيب لترتيب العناصر.
تسمية العائلات
- تم تقسيم العائلات في الجدول إلى A (تمثيلية) و B (انتقالية) ، يتم تحديدها بالأحرف والأرقام.
- أنت العناصر التمثيلية العائلات 0 ، 1 أ ، 2 أ ، 3 أ ، 4 أ ، 5 أ ، 6 أ و 7 أ تتوافق.
- أنت عناصر الانتقال العائلات 1B ، 2B ، 3B ، 4B ، 5B ، 6B ، 7B و 8B تتوافق.
- من خلال تحديد الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) ، تم تحديد العائلات في مجموعات من 1 إلى 18.
الجدول الدوري والتوزيع الإلكتروني
تحدث أوجه التشابه بين عناصر نفس العائلة لأن عدد إلكترونات التكافؤ للذرة في الحالة الأرضية هو نفسه بالنسبة لأعضاء مجموعة معينة.
على سبيل المثال:
| مجموعة 1 | التوزيع الإلكتروني |
|---|---|
| 3اقرأ | 2-1 |
| 11في | 2-8-1 |
| 19ك | 2-8-8-1 |
| 37ر | 2-8-18-8-1 |
| 55سي اس | 2-8-18-18-8-1 |
| 87الاب | 2-8-18-32-18-8-1 |
يتم توزيع إلكترونات المجموعة 1 على أكثر من مستوى طاقة واحد ، ولكن جميعها بها إلكترون تكافؤ.
مع ذلك ، نلاحظ أن صنع ملف التوزيع الإلكتروني للذرة في الحالة الأرضية ، نجد موقعها في الجدول الدوري.
العناصر التمثيلية
تُظهر العناصر التمثيلية سلوكًا كيميائيًا أقل تعقيدًا نسبيًا من العناصر الانتقالية وتشكل معظم المواد من حولنا.
يتم إعطاء بعض عائلات العناصر التمثيلية أسماء خاصة ، كما هو موضح أدناه:
مجموعة |
عائلة | اسم محدد | أصل الاسم | عناصر | التكوين الإلكترونية |
|---|---|---|---|---|---|
| 1 | 1 أ | الفلزات القلوية | من اللاتينية قلوي، وهو ما يعني "الرمادي من النباتات". | Li و Na و K و Rb و Cs و Fr | نحن1 |
| 2 | 2 أ | المعادن الأرضية القلوية | يشير المصطلح "أرضي" إلى "الموجود على الأرض". | Be و Mg و Ca و Sr و Ba و Ra | نحن2 |
| 13 | 3 أ | عائلة البورون | اسم العنصر الأول في الأسرة. | B و Al و Ga و In و Tl و Nh. | نحن2np1 |
| 14 | 4 ا | عائلة الكربون | اسم العنصر الأول في الأسرة. | C و Si و Ge و Sn و Pb و Fl. | نحن2np2 |
| 15 | 5 أ | عائلة النيتروجين | اسم العنصر الأول في الأسرة. | N و P و As و Sb و Bi و Mc. | نحن2np3 |
| 16 | 6 أ | نشكل | من اليونانية الخنجر ، لأنها عناصر موجودة في خامات النحاس. | O و S و Se و Te و Po و Lv. | نحن2np4 |
| 17 | 7 أ | الهالوجينات | التعبير اليوناني يعني صانعي الملح. | F و Cl و Br و I و At و Ts. | نحن2np5 |
| 18 | 0 | غازات نبيلة | اعتبر أنه لا يتفاعل مع مواد أخرى. | هو ، ني ، أر ، كر ، إكس ، رع ، أوغ. | 1 ثانية2 (هو) أو نحن2np6 |
من خلال الجدول يمكننا أن نرى ما يلي:
- يتم تصنيف العناصر المعروضة أعلاه على أنها تمثيلية لأنها تحتوي على الإلكترون الأكثر نشاطًا في المستوى الفرعي s أو p.
- يتم توزيع الإلكترونات على مستويات الطاقة وتمثل n المستوى الأبعد للذرة في الحالة الأرضية.
- العناصر التمثيلية ، وفقًا لتوصية IUPAC ، تنتمي إلى المجموعات أو العائلات 1،2،13،14،15،16،17 و 18.
ا هيدروجين يتم تصنيفها بصرف النظر عن العناصر الأخرى. حتى مع التكوين الإلكتروني 1s1، فهو ليس جزءًا من المجموعة 1 لتقديمه سلوكًا فريدًا.
عناصر الانتقال
تتوافق عناصر الانتقال مع المجموعات من 3 إلى 12. يتلقون هذا الاسم لأن لديهم خصائص وسيطة بين المجموعتين 1 و 2 والعناصر غير المعدنية التمثيلية.
أنت معادن انتقالية يتم تعريفها بواسطة IUPAC على النحو التالي:
يحتوي عنصر الانتقال على مستوى فرعي d غير مكتمل أو قد يشكل كاتيونات بمستوى فرعي d غير مكتمل.
عندما يكون الإلكترون الأكثر نشاطًا للذرة في الحالة الأرضية في مستوى ثانوي غير مكتمل ، يتم وصفه بأنه انتقال خارجي.
اللانثانيدات والأكتينيدات هي عناصر انتقالية داخلية لأنها تحتوي على مستوى فرعي واحد على الأقل غير مكتمل.
عندما تحتوي العناصر على إلكترونات تملأ المدارات d أو f ، فإنها تظهر خصائص متشابهة ويمكن تصنيفها إلى عناصر الانتقال الخارجي أو الداخلي.
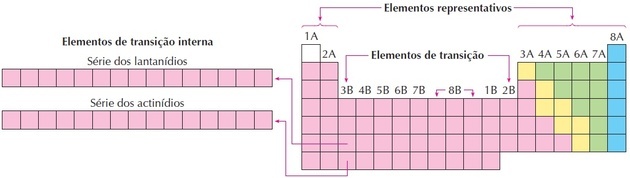
كما نرى في الصورة ، تتوافق العائلة 8B مع 3 أعمدة ، وهي مجموعات 8 و 9 و 10 ، والتي تم تجميعها على هذا النحو لأن لها خصائص متشابهة.
الخصائص الرئيسية للعائلات
يوضح الجدول أدناه الخصائص الرئيسية للمجموعات في الجدول الدوري:
| مجموعة | سمات | مواد مركبة اكثر شيوعا |
تكرارات |
|---|---|---|---|
| 1 | صلبة ولامعة في الظروف المحيطة. موصلات كهربائية متفاعلة للغاية ولينة وجيدة. | الأملاح والهيدروكسيدات والأكاسيد |
تفاعل مع الهالوجينات وشكل الأملاح. |
| 2 | أقل تفاعلًا وأصعب من المجموعة 1. المواد الصلبة الفضية ذات الموصلية الجيدة. | الأملاح والهيدروكسيدات والأكاسيد |
تشكيل الأملاح والأكاسيد. |
| 3 إلى 12 | إنهم يشكلون مجمعات. وهي مواد صلبة معدنية صلبة وهشة ، باستثناء الزئبق السائل. | الأملاح والأكاسيد والمجمعات. مثال: AgNO3، TiO و [Cr (OH)3(ح2س)3] |
في المعادن في شكل أكاسيد. |
| 13 | المواد الصلبة في الظروف المحيطة ، الفضة ، باستثناء البورون. | أكاسيد مثال: ب2ا3 |
في المعادن في شكل أكاسيد. |
| 14 | صلبة في الظروف المحيطة. | يمكن لذرات C و Si ترتيب نفسها في سلاسل وإنتاج مجموعة كبيرة ومتنوعة من المواد. | في الكائنات الحية وفي شكل سيليكات أو أكاسيد. |
| 15 | المواد الصلبة ما عدا النيتروجين الغازي في الظروف المحيطة. | أكاسيد وأحماض مثال: لا2 و ح3غبار4 |
الغلاف الجوي والكائنات الحية والمعادن. |
| 16 | المواد الصلبة ما عدا الأكسجين الغازي في الظروف المحيطة. | الكبريتيدات والأكاسيد على سبيل المثال: ZnS و SiO2 |
الغلاف الجوي والكائنات الحية والمعادن. |
| 17 | إنها تشكل جزيئات ثنائية الذرة وتكون شديدة التفاعل. هم موصلات سيئة للكهرباء والحرارة. إنهم عدوانيون للكائنات الحية والبيئة. | الأحماض والأملاح. على سبيل المثال: HCl و KBr |
موجودة في المواد عضوي ومعدني. |
| 18 | إنها مستقرة جدًا وتوجد في شكل غازات. | هم بالكاد يشكلون مواد مركبة. | الغازات في الغلاف الجوي. |
الخصائص الكيميائية والفيزيائية تميز عائلة عن أخرى. كما رأينا ، ترتبط الخواص الكيميائية بـ الإلكترونات التكافؤومن خلالها تتفاعل ذرة مع أخرى ، وتكون مسؤولة عن السلوك الكيميائي و روابط كيميائية شكلت.
يمكن أن تختلف الخصائص الفيزيائية للعناصر في نفس المجموعة وفقًا للعدد الذري والكتلة.
تمارين
الآن بعد أن عرفت المزيد عن عائلات الجدول الدوري ، اختبر معلوماتك وشاهد ما تعلمته.
1) انظر في المقتطف التالي من الجدول الدوري.
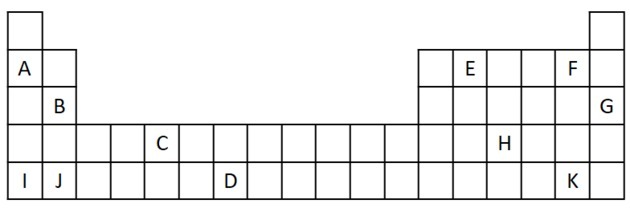
أ) قم بتسمية عنصرين لهما إلكترونان تكافؤان.
ب) حدد عنصر يتفاعل بعنف مع الماء ، مما ينتج هيدروكسيد فلز.
ج) أشر إلى عنصر غير تفاعلي.
د) حدد عنصرين يتحدان مع الفلزات القلوية لتكوين الأملاح.
رد:
أ) ب و ي
يتوافق إلكترونان تكافؤان مع المجموعة 2 ، التي لها تكوين إلكترون ns2 ويمثلها في التمرين B و J.
ب) أ أو ب أو أنا أو ج.
تمثل "أ" و "أنا" عناصر من العائلة 1 ؛ B و J من العائلة 2. كما رأينا في جدول الخصائص ، فإن عناصر المجموعة 1 و 2 شديدة التفاعل ويمكن أن تشكل هيدروكسيدات ، كما في الأمثلة المقدمة: KOH و Mg (OH)2.
ج) ز
الغازات النبيلة مستقرة جدًا وبالتالي فهي ليست شديدة التفاعل. تم إدراج الحرف G في الجدول كعنصر من عناصر هذه العائلة.
د) F و K.
تتفاعل الهالوجينات مع الفلزات القلوية لتكوين الأملاح. المثال الأكثر شيوعًا على ذلك هو ملح الطعام ، NaCl.
2) يوضح الشكل التالي ثلاثة عناصر كيميائية ، من اليسار إلى اليمين ، الليثيوم ، والصوديوم ، والبوتاسيوم.

حدد الخيار الذي يكمل بشكل صحيح كل من العبارات التالية.
1.1) "يمكننا القول أن الليثيوم والصوديوم والبوتاسيوم ...
(أ)... تنتمي إلى نفس الفترة. "
(ب)... له نفس العدد الذري. "
(ج)... ينتمون إلى نفس المجموعة ".
(د)... له نفس العدد الكتلي. "
1.2) "عناصر الليثيوم والصوديوم والبوتاسيوم ...
(أ)... له خصائص كيميائية متشابهة للغاية. "
(ب)... له خصائص كيميائية مختلفة جدًا. "
(ج)... غير فلزات. "
(د)... تتفاعل مع الماء لتشكيل المحاليل الحمضية. "
الإجابات:
1.1) (C) تنتمي إلى نفس المجموعة.
1.2) (أ) له خصائص كيميائية متشابهة جدًا.
يمكننا الحصول على هذه المعلومات من خلال الرجوع إلى الجدول الدوري أو عن طريق إجراء التوزيع الإلكتروني لعناصر الليثيوم والصوديوم والبوتاسيوم. سنرى أن الثلاثة لديهم إلكترون في غلاف التكافؤ ولأنهم جزء من نفس المجموعة ، فإن الخصائص الكيميائية متشابهة جدًا.
3) انظر إلى الجدول التالي ، حيث يتم تمثيل الأعداد الذرية والتوزيعات الإلكترونية لبعض العناصر الكيميائية.
| جزء | رمز كيميائي | العدد الذري | التوزيع الإلكتروني |
|---|---|---|---|
| الليثيوم | اقرأ | 3 | 2,1 |
| البريليوم | يكون | 4 | 2,2 |
| الفلور | F | 9 | 2,7 |
| نيون | هاه | 10 | 2,8 |
| الكلور | Cl | 17 | 2,8,7 |
| الأرجون | هواء | 18 | 2,8,8 |
| البوتاسيوم | ك | 19 | 2,8,8,1 |
| الكالسيوم | هنا | 20 | 2,8,8,2 |
حدد مجموعة كل عنصر.
رد:
الليثيوم والبوتاسيوم: المجموعة 1. (لديهم إلكترون في غلاف التكافؤ).
البريليوم والكالسيوم: المجموعة 2. (لديهم إلكترونان في غلاف التكافؤ).
الفلور والكلور: المجموعة 17. (لديهم سبعة إلكترونات في غلاف التكافؤ).
النيون والأرجون: المجموعة 18. (لديهم ثمانية إلكترونات في غلاف التكافؤ).
تحقق من أسئلة امتحان القبول مع التعليق المعلق في تمارين على الجدول الدوري والأسئلة غير المنشورة حول هذا الموضوع في تمارين على تنظيم الجدول الدوري.