الكلوريدات هي تلك المركبات الأيونية التي تحتوي على الأنيون Cℓ-1.
الكلور من عائلة 17 أو 7A ، وعدده الذري يساوي 17 وله 7 إلكترونات في غلاف التكافؤ (الغلاف الإلكتروني الخارجي للذرة). بالنسبة الى قاعدة من الثماني, لكي تكون مستقرة ، يجب أن تحتوي على 8 إلكترونات في هذه الغلاف الأخير ، وبالتالي تحتاج إلى تلقي إلكترون واحد آخر. عندما يحدث هذا ، أي عندما يتلقى إلكترونًا ، بشكل عام ، من رابطة أيونية مع معدن ، يتم تشكيل â.كلوريد نيون (Cℓ-1) ، يصبح المعدن الذي تخلى عن الإلكترون كاتيون والمادة المتكونة أيونية.
الكلوريدات عبارة عن أملاح مشتقة من تفاعل قاعدة مع حمض الهيدروكلوريك (HCℓ(هنا)). توفر القاعدة الكاتيون وحمض الهيدروكلوريك يوفر أيون الكلوريد:
قاعدة عامة + حمض الهيدروكلوريك → كلوريد + ماء
جأوه + حCℓ → جCℓ + ح2ا
يتم تصنيف الكلوريدات على أنها ملح غيرعضوي، لأنهم في وسط مائي يطلقون كاتيون غير H.+ وإطلاق أنيون الكلوريد ، وليس الهيدروكسيل (OH-).
دائمًا ما تتبع تسمية الكلوريدات هذه القاعدة: كلوريد +de + (اسم العنصر المرتبط بالكلور). في يتم تشكيل الصيغ الخاصة بك استبدال الرسوم الأيونية بالمؤشرات (الرقم الموجود في أسفل يمين رمز العنصر ، يشير إلى عدد ذرات هذا العنصر الموجودة في تكوين الروابط).
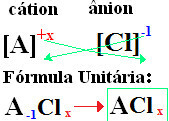
إذا الفهرس هو "1" ، ولست بحاجة إلى كتابته في الصيغة كما هو موضح أدناه:
في+1 Cℓ-1 → في1Cℓ1 → فيCℓ: كلوريد الصوديوم.
ك+1 Cℓ-1 → كCℓ: كلوريد البوتاسيوم.
هنا+2 Cℓ-1→كاكو2: كلوريد الكالسيوم؛
با+2 Cℓ-1→ بهنا2: كلوريد الباريوم.
أ+3 Cℓ-1→ACℓ3: كلوريد الألومنيوم.
ومع ذلك ، كما هو موضح في النص "المواد الأيونية للمجموعة: كلوريد ، كربونات ، نترات وكبريتات"، كما هو الحال مع جميع المواد الأيونية ، لا تحتوي الكلوريدات على صيغها الوحدوية المعزولة في الطبيعة ، حيث تجذب أيوناتها بعضها البعض بشكل متبادل وتشكل شبكات بلورية.
المثال الرئيسي للكلوريد الذي لدينا في حياتنا اليومية هو كلوريد الصوديوم ، NaCℓ ، ملح الطعام. انظر الرابطة الأيونية التي تؤدي إلى تكوينها (حيث يتبرع الصوديوم بإلكترون للكلور) وأسفل الشبكة البلورية لهذا الملح:
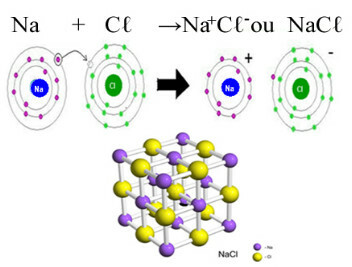
في الشبكة البلورية لكلوريد الصوديوم كل أنيون Cℓ- محاط بـ 6 كاتيونات Na+ والعكس صحيح ، لذا فإن رقم التنسيق لهذه الشبكة البلورية هو 6.
جميع الكلوريدات المواد الصلبة في ظروف محيطة وهادئة ذوبان في الماء، من بين الأملاح الأكثر شيوعًا الموجودة في حياتنا اليومية ، مع الأخذ في الاعتبار أن العديد منها موجودة في المياه المعدنية الذائبة ، مياه الشرب ، مياه الصنبور ، الأنهار ، البحار ، من بينها الآخرين. من بين الاستثناءات ، كونها كلوريدات غير قابلة للذوبان في الماء ، كلوريد الفضة (AgCℓ - كما هو موضح في الشكل التالي) ، من مركبات الرصاص والنحاس والزئبق.

كلوريد الفضة غير القابل للذوبان في الماء *
الأيونات-1 من الكلوريدات التي نتناولها ، بشكل رئيسي في الملح والأسماك واللحوم، مهمة لبعض وظائف جسم الإنسان ، حيث أنها تمثل الأنيون الرئيسي خارج الخلية ، فهي موجودة في العصير. المعدة ، تنظيم سوائل الجسم ، مثل توزيع الماء في الجسم ، والحفاظ على ضغط البلازما التناضحي وحيادها. كهربائي.
يمكن أن يسبب نقصه القلق والإسهال ومشاكل الدورة الدموية. يفرز فائضه عن طريق البول (في المتوسط ، يفرز كل شخص حوالي 4 جم من الكلوريد يوميًا) والعرق والبراز.
*حقوق الصورة: مؤلف: داني س. / صورة مستخرجة من: ويكيميديا كومنز
بقلم جينيفر فوغاسا
تخرج في الكيمياء
