الجدول الدوري هو وسيلة لتنظيم جميع العناصر الكيميائية حسب خصائصها وإظهار بعض المعلومات عنها.
في الحياة اليومية ، التنظيم مهم جدًا لجعل حياتنا أسهل. على سبيل المثال ، تخيل أن خزانة ملابسك فوضوية ، مع اختلاط الجوارب بالقمصان والسراويل. سيكون الأمر صعبًا للغاية وسيستغرق وقتًا أطول للعثور على جورب معين تريد ارتدائه ، أليس كذلك ؟! ولكن إذا قمت بتنظيم خزانة ملابسك ووضعت كل جواربك في درج واحد ، فلديك درج. بالنسبة للقمصان ، وآخر للسراويل القصيرة وما إلى ذلك ، سيكون من الأسهل العثور على ماذا يحتاج. وكلما زاد عدد الملابس التي تمتلكها ، زادت الحاجة إلى التنظيم.
وبالمثل ، اكتشف العلماء العديد من العناصر الكيميائية بمرور الوقت. لإعطائك فكرة ، في عام 1850 ، كان هناك حوالي 60 عنصرًا معروفًا ، ولكن نحن نعلم اليوم وجود 118. وهكذا نشأت الحاجة إلى تنظيم هذه العناصر الكيميائية بطريقة تسهل فهم خصائصها. هذا هو دور الجدول الدوري للعناصر الكيميائية.
الجدول الدوري الذي نستخدمه اليوم مرتب في خطوط أفقية بترتيب تصاعدي للعدد الذري.
يجب عليك مراجعة الجدول الدوري كما لو كنت تقرأ نصًا عاديًا ، أي أنك دائمًا يبدأ بالصف الأول ومن الجانب الأيسر إلى اليمين ثم ينتقل إلى الصف التالي خطوط.
تم وضع العناصر الكيميائية في الجدول الدوري في مربعات منفصلة ، حيث يكون رمز العنصر في عادة ما يتم كتابة النصف وقيمة العدد الذري في الأعلى ، كما هو موضح في مثال الهيدروجين أدناه:
رمز الهيدروجين ورقمه الذري كما هو موضح في الجدول الدوري
العدد الذري هو مقدار البروتونات أو الشحنات الموجبة التي تمتلكها ذرات العنصر. هذه القيمة تساوي عدد الإلكترونات عندما تكون الذرة في حالتها الأساسية.الهيدروجين عنصر يحتوي على بروتون واحد فقط ، أي أن رقمه الذري هو 1. لذلك ، الهيدروجين هو العنصر الأول الموضوع في الجدول. العنصر التالي الموجود على نفس خط الهيدروجين هو الهيليوم ، لأنه يحتوي على عدد ذري يساوي 2.
بالانتقال إلى الصف السفلي ، الأول هو الليثيوم برقم ذري يساوي 3، بجانبه البريليوم برقم ذري 4 وهكذا.انظر إلى الأسطر الأولى من الجدول الدوري الموضح أدناه ولاحظ أن ترتيب العدد الذري ينمو بشكل صحيح.
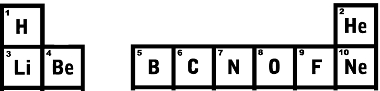
أول سطرين من الجدول الدوري
هناك سبعة أسطر في الجدول الدوري وتسمى هذه الأسطر فترات. نظرة:

فترات الجدول الدوري
هناك 18 عمودًا تم استدعاؤها العائلات أو المجموعات. جانب مهم هو ذلك العناصر التي تنتمي إلى نفس العائلة هي تلك التي لها خصائص فيزيائية وكيميائية متشابهة.

عائلات الجدول الدوري أو المجموعات
دعونا نرى ما إذا كنت تفهم؟ أخبرني ما العنصر الكيميائي الذي ينتمي إلى الفترة الرابعة والعائلة 16؟
إذا قلت سي (السيلينيوم) ، فأنت على حق! أخبرني الآن ما هو رقمه الذري. هذا صحيح ، إنها 34.
في كل مربع صغير يراه العنصر ، توجد أيضًا معلومات مهمة أخرى ، مثل الكتلة الذرية و ال الإلكترونات الموجودة في كل طبقة إلكترونية من الذرات. على سبيل المثال ، انظر في الصورة التالية أن نيون له رمز Ne ، وعدده الذري يساوي 10 ، وكتلته الذرية تساوي 20.1797 u و تتوزع الإلكترونات على هذا النحو في طبقاتها: 2-8 ، أي في الطبقة الأقرب للنواة يوجد إلكترونان وفي الأبعد يوجد ثمانية إلكترونين الإلكترونات.

رمز النيون على الجدول الدوري وذرته
لاحظ الآن جانبين مهمين: (1) النيون فقط اثنين من المدارات أو طبقات حيث توجد إلكتروناتك ، لهذا السبب يحتل الفترة الثانية (السطر الثاني) ؛و (2) لديه ثمانية إلكترونات على الطبقة الأخيرة ، لهذا السبب هي العائلة 18.
هذا يوضح لنا ما يلي:
* العناصر الموجودة في نفس الفترة من الجدول الدوري لها نفس القدر من الطبقات الإلكترونية ، ويمكن أن تحتوي على سبع طبقات كحد أقصى ؛
* العناصر الكيميائية الموجودة في نفس العائلة في الجدول الدوري لها نفس عدد الإلكترونات في غلاف الإلكترون الأخير:
* الأسرة 1: لديك كل 1 إلكترون في الطبقة الإلكترونية الأخيرة ؛
* الأسرة 2: لديك كل 2 إلكترونات في الطبقة الإلكترونية الأخيرة ؛
* الأسرة 13: لديك كل 3 إلكترونات في الطبقة الإلكترونية الأخيرة ؛
* الأسرة 14: لديك كل 4 إلكترونات في الطبقة الإلكترونية الأخيرة ؛
* الأسرة 15: لديك كل 5 إلكترونات في الطبقة الإلكترونية الأخيرة ؛
* الأسرة 16: لديك كل 6 إلكترونات في الطبقة الإلكترونية الأخيرة ؛
* الأسرة 17: لديك كل 7 إلكترونات في الطبقة الإلكترونية الأخيرة ؛
* الأسرة 18: لديك كل 8 إلكترونات في آخر طبقة إلكترونية.
يتم إعطاء بعض المجموعات أو العائلات في الجدول الدوري أسماء محددة ، انظر بعضًا:
الأسرة 1: الفلزات القلوية؛
الأسرة 2: المعادن الأرضية القلوية؛
الأسرة 16: نكلوجينات.
الأسرة 17: الهالوجينات.
الأسرة 18: غازات نبيلة.

تنظيم عائلات الجدول الدوري
مرة أخرى دعونا نختبر معلوماتك. أجب عن الأسئلة التالية فقط بالرجوع إلى الجدول الدوري:
1- ما اسم عائلة الكلور؟
2- ما هو عددها الذري وكتلتها الذرية؟
3- كم عدد الطبقات الإلكترونية الموجودة في ذرة الكلور؟
4- كم عدد إلكترونات ذرة الكلور في غلافها الإلكتروني الأخير؟
الإجابات:
1- الهالوجينات (الأسرة 17).
2- العدد الذري للكلور هو 17 وكتلته الذرية تساوي 35.45 ش.
3- تحتوي ذرة الكلور على ثلاث طبقات إلكترونية لأنها تنتمي إلى الفترة الثالثة من الجدول.
4- تحتوي ذرة الكلور على سبعة إلكترونات في غلاف التكافؤ لأنها تنتمي إلى العائلة 17.
لا تزال هناك معلومات مهمة أخرى ينقلها إلينا الجدول الدوري والتي سنتحدث عنها بشكل أفضل في النصوص اللاحقة. لكن العناصر التي تمت مناقشتها هنا هي العناصر الرئيسية لكي تبدأ في فهم كيفية تنظيم العناصر فيها. تذكر أن الطاولة ليست مصممة للتزيين ، لكن يجب أن تعرفها جيدًا لتتمكن من الرجوع إليها عند الضرورة.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
اغتنم الفرصة للتحقق من دروس الفيديو المتعلقة بالموضوع: