Allotropy هي ظاهرة تحدث عندما يمتلك نفس العنصر الكيميائي خاصية تكوين أكثر من مادة بسيطة واحدة.. قد تختلف هذه الأصناف المتآصلة بسبب عدد ذرات العنصر المرتبطة ببعضها البعض في جزيء أو بسبب ترتيب الذرات في الشبكة البلورية.
أحد العناصر التي تحتوي على أصناف متآصلة هو الفوسفور (P) ، وأكثرها شيوعًا هو الفوسفور الأبيض انها ال الفوسفور الأحمر. لا يختلف هذان الشكلان المتآصلان للفوسفور باختلاف ترتيبهما المكاني ، حيث يتكون كلاهما أساسًا من جزيئات رباعية السطوح ، ولكن تختلف كمية ذرات الفوسفور في كل واحدة.
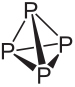
انظر الدستور والخصائص الرئيسية للفوسفور الأبيض والأحمر:
- الفوسفور الأبيض:
الصيغة الجزيئية للفوسفور الأبيض هي ص4، مما يعني أن جزيئاته تتكون من أربع ذرات فسفور.

هذا النوع من الفوسفور شديد التفاعل ، ويرجع ذلك إلى حد كبير إلى التوتر عند زوايا 60 درجة بين روابطه. إنه تفاعلي لدرجة أنه يجب تخزينه في الماء حتى لا يتلامس مع الهواء وينفجر. يجب توخي الحذر الشديد عند التعامل معها ، لأنها تسبب حروقًا جلدية شديدة وتسممًا إذا ابتلع (فقط 0.1 جرام من الفسفور الأبيض يمكن أن يؤدي إلى الوفاة).
كما ترون أدناه ، الفسفور الأبيض مادة صلبة تشبه الشمع الأبيض.
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)

تخزين الفوسفور الأبيض في الماء حتى لا يتلامس مع الهواء *
إذا تم تسخينه في غياب الهواء ، يتحول الفسفور الأبيض إلى فوسفور أحمر.
- الفوسفور الأحمر:
لا يحتوي الفسفور الأحمر على بنية محددة ، ولكن هناك دليل على أنه جزيئات كبيرة تكونت من ارتباط الهياكل الرباعية السطوح المذكورة (P4) ، ويمثلها صلا.
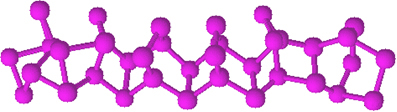
إنه أقل تفاعلًا من الفوسفور الأبيض ، ومع ذلك ، يمكن أن يشتعل إذا تم فركه. لهذا السبب يتم استخدامه على الأسطح الجانبية لعلب الثقاب. عندما نفرك عود الأسنان على سطح الصندوق ، يشتعل عود الثقاب ، ويشعل بدوره المادة شديدة الاشتعال على رأس عود الأسنان.
في بعض البلدان توضع المطابقة على رأس عود الأسنان على شكل P.4س3.
الفسفور الأحمر عبارة عن مسحوق غير متبلور ، أي ليس له بنية بلورية ، ولونه أحمر غامق ، كما هو موضح أدناه:

مسحوق الفوسفور الأحمر.
* يعود تأليف الصور إلى W. يمكن العثور على Oelen وهي هنا.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "تآصل الفوسفور" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/alotropia-fosforo.htm. تم الوصول إليه في 28 يونيو 2021.
كيمياء
ما هو التآصل ، المواد البسيطة ، غاز الأكسجين ، الأوزون ، الأشكال المتآصلة ، عنصر الأكسجين الكيميائي ، الأشعة فوق البنفسجية من الشمس ، الماس ، الجرافيت ، الذرية ، الفوسفور الأبيض.