ال ثابت التأين يعطي ماء(كو) ، ا إمكانات الهيدروجين(الرقم الهيدروجيني) انها ال الجهد الهيدروكسيليوني (pOH) هم انهم الإجراءات مهم للحسابات التي تنطوي على التوازن الكيميائي في المحاليل الحمضية والقاعدية ، وكذلك في تحديد تركيز أيونات الهيدروجين+ وأوه- من الحلول المعنية.
ما هو Kw؟
المنتج الأيوني للماء ، أو Kw (this ثيعني ماء - الماء ، باللغة الإنجليزية) ، هو الثابت المستخدم لتمثيل التوازن الناتج عن التأين الذاتي للماء. حتى بمعدل ضئيل جدًا ، يتأين الماء لإنتاج H أيونات+ وأوه-، وفقًا للمعادلة الكيميائية التالية:
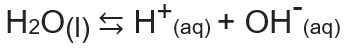
عند تحليل المعادلة ، ندرك أنه عندما يكون ملف التأين من جزيء من الماء النقي يتم إنشاء H أيون.+ وأيون OH-، وهذا هو سيكون تركيز هذه الأيونات هو نفسه دائمًا. حتى عندما تكون هناك زيادة في درجة الحرارة ، مما يؤدي إلى زيادة معدل التأين ، تظل التركيزات كما هي.
اقرأ أيضا:طاقة التأين
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
بناءً على القياسات التجريبية ، تم حساب تركيز أيونات H+ وأوه- (الناتج عن التأين الذاتي للماء) عند 25 درجة مئوية وقيمة 1. 10-7 مول / لتر. هذا هو، من إجمالي 1 مليار جزيء ماء
، فقط اثنان يخضعان للتأين. هذا يدل على أن الماء النقي لديه درجة منخفضة من التأين ويفسر الانخفاض الشديد الموصلية الكهربائية من الماء النقي.بالنظر إلى ما تم عرضه أعلاه ، يمكننا كتابة التعبير من ثابت توازن الماء:

استخدام قيم تركيز أيون الهيدروجين+ وأوه- عند 25 درجة مئوية ، يمكننا حساب قيمة K.ث:
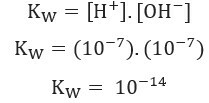
كما ذكرنا سابقًا ، هذه القيمة كث يتغير مع زيادة درجة الحرارةكما هو موضح في الجدول أدناه:
T (درجة مئوية) |
كث |
10 |
0,29. 10-14 |
20 |
0,68. 10-14 |
25 |
1,00. 10-14 |
30 |
1,47. 10-14 |
40 |
2,92. 10-14 |
60 |
9,40. 10-14 |
لمعرفة المزيد حول هذا الموضوع ، اقرأ نصنا: منتج الماء الأيوني.
ما هو الرقم الهيدروجيني و pOH؟

اختصار الرقم الهيدروجيني يعني إمكانات الهيدروجين وتم إنشاؤه بواسطة عالم الكيمياء الحيوية الدنماركي سورين سورنسن، في عام 1909 ، لتسهيل العمل مع تركيزات أيون الهيدروجين [ح+] ، والتي يتم التعبير عنها عادة بالأرقام العشرية. لمعرفة المزيد حول هذا الموضوع ، اقرأ نصنا: ما هو الرقم الهيدروجيني؟
هذا النوع من التدوين يشير إلى محتوى أيون H+ موجود في الحل ويتم تعريفه بالتعبير الرياضي:
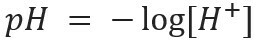
وبالمثل ، يمكننا تحديد pOH أو الكمون الهيدروكسي ، الذي يخبرنا محتوى أيون OH- موجود في الحل. تعبيرها الرياضي هو:
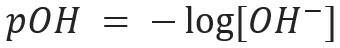
في المحلول المائي سيكون هناك دائمًا H أيونات+ وأوه- (بسبب التأين الذي يعاني منه الماء) والذي سيتم استخدامه لتوصيف محلول في حمضي أو أساسي. كلما زاد عدد أيونات H+ يوجد في المحلول ، كلما كانت حمضية أكثر. وبالتالي ، فإن وجود أيونات OH- في الحل ستجعله أكثر أساسية. إذا كان هناك توازن في كمية هذه الأيونات ، فسيتم تصنيف المحلول على أنه حيادي.
مقياس درجة الحموضة
يتم عرض مقياس الأس الهيدروجيني بقيم تتراوح من 0 إلى 14 (تم قياس القيم عند 25 درجة مئوية). انظر إلى مقياس الأس الهيدروجيني في الصورة أدناه:

انخفض الرقم الهيدروجينيمن الحل ،أكبر حموضته ، وكلما اقتربنا من نهاية المقياس ، أي أقرب إلى 14 ، زاد طابعه الأساسي. على سبيل المثال ، يحتوي عصير الليمون على درجة حموضة 2 ، بينما تحتوي مواد التبييض على درجة حموضة 12.
كيفية حساب الأس الهيدروجيني و الأس الهيدروجيني
معرفة تركيز الأيونات، في وسعنا احسب القيم الأس الهيدروجيني و الأس الهيدروجيني للحلول ، ومعرفة القيم المحتملة ، نحسب تركيز الأيونات في المحاليل. للقيام بذلك ، يتم استخدام التعبيرات التالية:
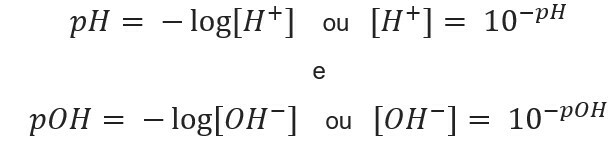
دعنا نذهب إلى الأمثلة:
مثال 1
إذا أردنا معرفة الرقم الهيدروجيني لمحلول مع [H+] = 0.001 مول / لتر ، فقط استخدم الصيغة المعروضة مسبقًا:
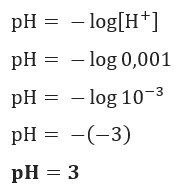
مثال 2
الآن ، لمعرفة ما هو تركيز OH- لحل مع pOH = 5 ، فقط استبدل القيمة في الصيغة التالية:

إذا طبقنا نفس مقياس الإمكانات للتوازن الأيوني للماء ، فسنحصل على:
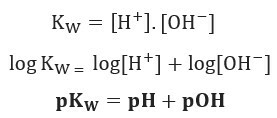
كما هو مذكور ، عند 25 درجة مئوية ، Kw = 10-14. لذلك:

باستخدام هذا ، يمكننا حساب الأس الهيدروجيني لمحلول بناءً على الرقم الهيدروجيني. إذا كان لدينا محلول برقم هيدروجيني 3 ، فسيكون الرقم الهيدروجيني له 11.
تعرف أكثر: وسائط محايدة وحمضية وقاعدية
تمارين حلها
السؤال 1 (UEFS-BA) تركيز أيونات OH–(هنا) في محلول هيدروكسيد الأمونيوم ، عند 25 درجة مئوية ، يساوي 1.10–3 مول / لتر. الرقم الهيدروجيني لهذا الحل هو:
أ) 0
ب) 1
ج) 3
د) 11
هـ) 13
القرار: الحرف ج. إذا كان لدينا [OH–] = 10–3 مول / لتر ، لذلك سيكون pOH الخاص بك يساوي 3.
نظرة:
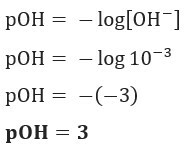
السؤال 2 (UEA-AM) ضع في اعتبارك المعلومات التالية ، التي تم الحصول عليها من ملصق المياه المعدنية في مدينة بورتو سيجورو (BA):
نترات 1.45 مجم / لتر
درجة الحموضة عند 25 درجة مئوية 4.51
هذه المياه المعدنية
أ) حامضي وله [H+] –].
ب) حامضي وله [H+]> [أوه–].
ج) محايد وله [H+] = [أوه–].
د) أساسية ولها [H+]> [أوه–].
هـ) أساسية ولها [H.+] –].
القرار: حرف الباء. نظرًا لأن الرقم الهيدروجيني للمياه المعدنية الموضح على الملصق أقل من 7 ، يمكننا القول أنه محلول حمضي ، وبالتالي ، تركيز H أيونات+ أكبر من OH-.
السؤال 3 (UEA-AM) تتمثل إحدى طرق إنتاج الهيدروجين الغازي بسرعة في المختبر في تفاعل مسحوق الزنك المعدني مع حمض الهيدروكلوريك (HCl) ، بتركيز 1.0 مول / لتر:
الزنك (ق) + 2 حمض الهيدروكلوريك (عبد القدير) → زنكل2 (عبد القدير) + ح2 (ز)
بالنظر إلى أن حمض الهيدروكلوريك مؤين بنسبة 100 ٪ وأن المحلول عند 25 درجة مئوية ، فمن الصحيح أن نذكر أن الرقم الهيدروجيني لمحلول حمض الهيدروكلوريك المذكور في النص هو
- 0
- 1
- 3
- 13
- 14
القرار:الحرف ا. يمكننا حساب الرقم الهيدروجيني للمحلول باستخدام تركيز حمض الهيدروكلوريك الموضح في النص ، نظرًا لأنه مؤين بنسبة 100٪ ، فإن تركيز [H+] سيكون هو نفسه ، لأنه لكل جزيء HCl مؤين ، أيون H واحد+ سيتم إنشاؤه. لذلك:
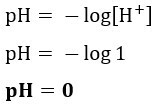
بقلم فيكتور فيريرا
مدرس كيمياء

