في روابط تساهمية، وتسمى أيضا روابط جزيئية أو أحادية القطب، هي تلك التي تحدث بين ذرات العناصر الكهربية، وهذا هو ، مع وجود ميل لتلقي الإلكترونات ، وإنشاء رابطة تقاسم الإلكترونات من قذائف التكافؤ.
يمكن أن يحدث الترابط التساهمي بين العناصر التالية: الهيدروجين وغير الفلزات وشبه المعادن. لا تشارك المعادن أبدًا في هذا النوع من الترابط.
لنفكر في مثال بسيط للرابطة التساهمية: الرابطة المكونة لغاز الهيدروجين (H2):
H + H → H2
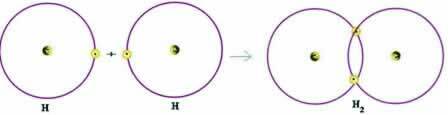
لاحظ أن كلتا الذرتين بحاجة إلى تلقي إلكترون لإكمال غلاف التكافؤ - وفقًا لقاعدة الثمانية - وبهذه الطريقة ، للبقاء مستقرًا. لذلك ، شاركوا إلكتروناتهم ، وبهذه الطريقة ، كان لكل منهما إلكترونان ، وكان لهما غلاف K الكامل واكتسب تكوين الهيليوم الغاز النبيل.
هذه المشاركة للإلكترونات هي ما يميز هذا النوع من الروابط عن الترابط الأيوني ، حيث يتم نقل الإلكترون.
انظر الشكل أدناه للحصول على مثالين آخرين لهذه الحالة:
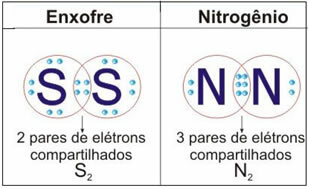
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
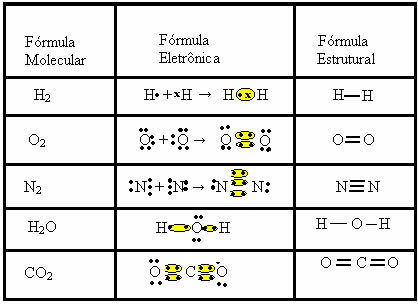
في هذا النوع من الروابط ، يوجد تكوين الجزيئات ، والتي يمكن تمثيلها بكل منها الصيغ الجزيئية، أي أبسط تمثيل يشير إلى عدد ذرات كل عنصر في الجزيء. بعض الأمثلة على الصيغ الجزيئية هي: H2، س2يا2، لا2، ح2O ، CO2، إلخ.
يمكن تمثيل الرابطة التساهمية بصيغتين أخريين:
- الصيغة الإلكترونية أو صيغة لويس: في هذه الصيغة تظهر أيضًا إلكترونات غلاف التكافؤ لكل ذرة وتكوين أزواج إلكترونية. هذه الإلكترونات يرمز لها بالإشارات . أو س ؛
- الصيغة الهيكلية المسطحة أو الصيغة الهيكلية كوبر: يُظهر روابط العناصر ، حيث يقابل كل زوج مشترك شرطة. إذا كانت مجرد شرطة ، نسميها ارتباطًا واحدًا ؛ إذا كان هناك اثنان ، رابطة مزدوجة ؛ وإذا كان هناك ثلاث شرطات ، رابطة ثلاثية.
انظر إلى أمثلة أخرى للروابط التساهمية التي تمثلها هذه الصيغ الكيميائية الثلاثة:
بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "الروابط التساهمية" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/ligacoes-covalentes.htm. تم الوصول إليه في 27 يونيو 2021.
