بدأ الكيميائي الفرنسي جوزيف لويس بروست (1754-1826) في إجراء تجارب دقيقة تتعلق بجماهير مكونات تفاعلات معينة.
على سبيل المثال ، العناصر المكونة للماء هي الهيدروجين والأكسجين. وجد بروست أنه في تفاعل تكوين الماء هذا ، يتفاعل الهيدروجين دائمًا مع الأكسجين بنسبة ثابتة ومحددة ، والتي كانت 1: 8 ، على التوالي. انظر كيف يحدث هذا أدناه:

لاحظ أن بغض النظر عن مقدار كتلة العناصر المستخدمة ، فإن النسبة ستكون هي نفسها دائمًا.
لاحظ بروست أن هذا لم يكن الحال مع الماء فقط ، ولكن مع جميع المواد الأخرى.
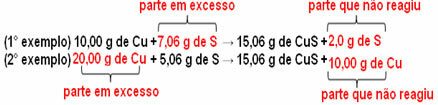
يتم تكوين 15.06 جم من كبريتيد النحاس (CuS) ، على سبيل المثال ، عن طريق تفاعل 10.00 جم من النحاس المعدني (Cu) مع 5.06 جم من الكبريت (S). لذا ، إذا ضاعفنا كمية النحاس (التي ستصل إلى 20.0 جم) ، وإذا أردنا أن يتفاعل كل النحاس ، سيكون من الضروري أيضًا مضاعفة كمية الكبريت ، إلى 10.12 جم ، بتكوين إجمالي يبلغ 30.12 جم من كبريتيد.
الآن ، إذا تمت إضافة مبلغ غير متناسب ، فسيتم ترك المبلغ الزائد ، ولن يتفاعل. لاحظ هذا أدناه:
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
لاحظ أن يحدث التفاعل فقط وفقًا للنسبة المحددة. لذلك ، في عام 1799 ، خلص بروست إلى أن ،
عندما تتحد عدة مواد لتكوين مركب ، يتم ذلك دائمًا في علاقة كتلة محددة.وهكذا ، خلق قانون يسمى قانون بروست, قانون النسب الثابتة أو قانون النسب المحددةوالتي نصت على الآتي:

هذا القانون و قانون لافوازييه (قانون الحفظ الشامل) تتم تسمية قوانين الوزن، لأنهم يتحدثون بأعداد كبيرة من المواد المعنية.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "قانون بروست أو قانون النسب الثابتة" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm. تم الوصول إليه في 27 يونيو 2021.