في العديد من الأدوية وفي المنتجات الغذائية السائلة والصلبة ، مثل الخل والبسكويت ، على سبيل المثال ، المحتوى في النسبة المئوية من كتلة المذاب (م1) بالنسبة إلى كتلة المحلول بأكمله (م = م1 + م2). هذا الحجم يسمى العنوان (T) أو النسبة المئوية الكتلية من حل.
يمكن التعبير عن تعريفه على النحو التالي:

وبالتالي ، يتم حسابها من خلال المعادلة الرياضية أدناه:
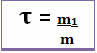
أو

نظرًا لأن كلا من المقام والبسط يتعاملان مع نفس الوحدة (وحدة الكتلة هي جرام - جم) ، فإن العنوان لا يحتوي على وحدة وهو أقل من 1.
وبالتالي ، إذا قلنا أن عنوان حل معين هو 0.4 ، فهذا يعني أنه بالنسبة لكل وحدة كتلة من المحلول ، يتوافق 0.4 مع كتلة المذاب. ومع ذلك ، غالبًا ما يتم التعبير عن العنوان كنسبة مئوية. للقيام بذلك ، ما عليك سوى ضرب القيمة التي تم العثور عليها في 100٪. في هذه الحالة يطلق عليه نسبة الكتلة (تي%) *
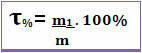
لاحظ الشكل أدناه ، حيث تُعطى النسبة المئوية لكلوريد الصوديوم في محلول ملحي بالكتلة:

يستخدم المحلول الملحي في علاج الجفاف ويحتوي على نسبة كتلية من كلوريد الصوديوم بنسبة 0.9٪.
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
في هذه الحالة ، فهذا يعني أنه لكل 100 جم أو 100 وحدة من هذا المحلول ، يوجد 0.9 جم أو 0.9٪ من المذاب ، أي من كلوريد الصوديوم (ملح الطعام - NaCl).
مثال آخر هو الخل: يوجد على الملصق الخاص به مؤشر على استخدام 5٪ من كتلة حمض الأسيتيك في تحضيره ، أي أنه يوجد 5 جرام من هذا الحمض لكل 100 جرام من المحلول.

يمكن أيضًا إعطاء العنوان بتنسيق نسبة الحجم. في هذه الحالة ، الاختلاف الوحيد هو أنه بدلاً من ربط كتلة المذاب بكتلة المحلول ؛ يرتبط حجم المذاب بحجم المحلول ، وفقًا للصيغة التالية:
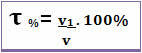
على سبيل المثال ، في حالة الكحول العادي ، الذي يحتوي على نسبة مئوية بالحجم 96٪ ، في 100 مل من المحلول ، 96 مل هو كحول.

* يستخدم مصطلح "العنوان" بشكل أكبر بين العلماء ، بينما يستخدم الفنيون والعديد من مؤلفي الكتب تعبير "النسبة المئوية للكتلة" في كثير من الأحيان.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "العنوان أو النسبة المئوية الجماعية" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/titulo-ou-porcentagem-massa.htm. تم الوصول إليه في 28 يونيو 2021.



