لن تفقد الذرة أو الأيون الإلكترونات إلا إذا استقبلت طاقة كافية ، وهي طاقة التأين.
في الممارسة العملية ، أهم شيء هو أول إمكانات التأين أو طاقة التأين الأولى ، والذي يتوافق مع إزالة الإلكترون الأول. عادة ما تكون أقل طاقة تأين ، لأن هذا الإلكترون هو الأبعد عن النواة ، و قوة جاذبيتها مع اللب هي الأدنى ، وتتطلب طاقة أقل وتكون أسهل أزلها.
علاوة على ذلك ، مع فقدان الإلكترونات ، يتناقص نصف القطر الذري ويصبح الأيون أكثر وأكثر إيجابية ، وبالتالي ، فإن التجاذب مع تصبح النواة أقوى وبالتالي ستكون هناك حاجة إلى مزيد من الطاقة لسحب الإلكترون التالي وهكذا على التوالي.
لنأخذ مثالاً على ذلك ، فإن ذرة الصوديوم لها أول طاقة تأين لها بقيمة 406 كيلو جول / مول. طاقة التأين الثانية لها هي 4560 ، أي أعلى بكثير من الأولى. هذا يدل على أن الصوديوم يستهلك طاقة أكبر بكثير لسحب إلكترونين من إلكترون واحد فقط. هذا هو السبب في أنه من الشائع في الطبيعة العثور على ذرات الصوديوم بتهمة +1.
لاحظ كيف يحدث هذا في حالة الألومنيوم أدناه:
13آل + 577.4 كيلوجول / مول → 13ال1++ و-
13آل + 1816.6 كيلوجول / مول → 13ال2++ و-
13آل + 2744.6 كيلوجول / مول → 13ال3++ و-
13آل + 11575.0 كيلوجول / مول → 13ال4++ و-
وبالتالي ، بالنسبة للألمنيوم لدينا الترتيب التالي لطاقة التأين (EI):
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
1st EI <2nd EI <3rd EI <<< 4th EI
من هذه الحقيقة يمكننا أن نستنتج أن:

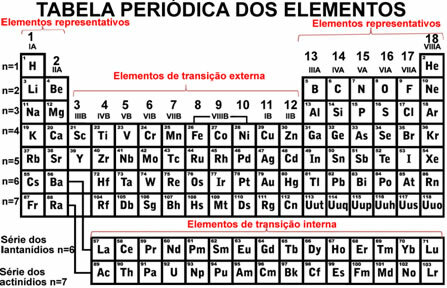
لذلك ، إذا أخذنا في الاعتبار العناصر في نفس العائلة أو في نفس الفترة من الجدول الدوري ، فسنرى ذلك كلما زادت الأعداد الذرية ، كلما انخفضت طاقات التأين ، لأنه كلما ابتعدت الإلكترونات عن النواة هم انهم. بهذه الطريقة ، تنمو طاقة التأين في الجدول الدوري من أسفل إلى أعلى ومن اليسار إلى اليمين. لذلك ، فإن طاقة التأين هي خاصية دورية.
انظر كيف هو موضح أدناه وقارن بين قيم طاقة التأين الأولى لبعض الذرات ، والتي تم الحصول عليها تجريبياً بالكيلوجول (كيلوجول):

لاحظ كيف أن قيم طاقات التأين للعناصر من الفترة الثانية من الجدول الدوري أكبر من تلك الموجودة في الفترة الثالثة ، وهكذا. انتبه أيضًا إلى حقيقة أن طاقات التأين الأولى لعناصر عائلة 1A أقل من طاقات 2A وهكذا.
العناصر التمثيلية ذات طاقة التأين المنخفضة تفقد الإلكترونات لتصبح مستقرة ، أي أن يكون لها تكوين الغاز النبيل. أولئك الذين لديهم طاقة تأين عالية (ametals) يتلقون الإلكترونات بدلاً من فقدها.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "طاقة التأين" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/energia-ionizacao.htm. تم الوصول إليه في 28 يونيو 2021.