النشاط الإشعاعي هي الخاصية التي تشبهها بعض الذرات اليورانيوم و مذياع، يجب أن تصدر بشكل عفوي طاقة في شكل حبيبات و لوح، يصبح العناصر الكيميائية أكثر استقرارًا وأخف وزنًا.
أنواع
النشاط الإشعاعي يقدم نفسه مع بطريقتين إشعاعات مختلفة: جسيم - ألفا (α) وبيتا (β); والموجات الكهرومغناطيسية - أشعة جاما (γ).
أشعة ألفا: هي جسيمات موجبة مكونة من بروتونين ونيوترونين ولها قوة اختراق منخفضة.
أشعة بيتا: هي جسيمات سالبة لا تحتوي على كتلة تتكون من إلكترون (كتلة ضئيلة) ، وقوة اختراقها أكبر من قوة أشعة ألفا ، ولكنها أقل من أشعة جاما.
جاما: هي موجات كهرومغناطيسية عالية الطاقة ، ولأنها ليست جسيمات ، فليس لها كتلة.
اقرأ أيضا: صيغ النشاط الإشعاعي
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
القوانين
يتبع الانبعاث الإشعاعي للجسيمات سلوكيات معينة تفسرها قوانين النشاط الإشعاعي (واحد لجسيم ألفا والآخر لجسيم بيتا) ، والذي وصفه الكيميائي الإنجليزية فريدريك سوديومن قبل الكيميائي والفيزيائي البولندي كازيميرز فاجانز.
قانون النشاط الإشعاعي الأول
وفقًا لهذا القانون ، عندما تصدر ذرة مشعة إشعاعًا من نوع ألفا ، فإنها ستؤدي إلى ظهور أ ذرة جديدة
مع جوهر يحتوي على اثنين من البروتونات و اثنين من النيوترونات أقل ، إجمالي الكتلة أربع وحدات أصغر. يمكننا تمثيل القانون الأول للنشاط الإشعاعي بالمعادلة العامة التالية: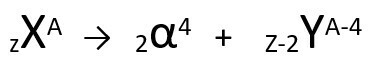
معادلة عامة للقانون الأول للنشاط الإشعاعي.
لنلقي نظرة على مثال:
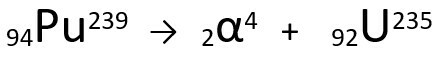
معادلة تمثل انبعاث جسيم ألفا بواسطة البلوتونيوم -239.
لاحظ أنه عند إصدار إشعاع ألفا ، فإن الذرة المشكلة حديثًا ، اليورانيوم -235 ، لها عدد كتلته أربع وحدات أصغر و العدد الذري لوحدتين أصغر - بالضبط القيم المقابلة لجسيم α المنبعث من نواة البلوتونيوم. لمعرفة المزيد حول ، انتقل إلى: قانون النشاط الإشعاعي الأول أو قانون سودي الأول.
القانون الثاني للنشاط الإشعاعي
يتحدث القانون الثاني عن قضية بيتا. عندما تنبعث ذرة جسيم بيتا ، يتكون من إلكترون وكتلة ضئيلة ، يكون الكتلة الذرية بقايا دون تغيير انها لك العدد الذري يزيد وحدة واحدة. بشكل عام ، فإننا نمثل ما يلي:
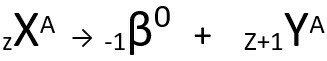
المعادلة العامة للقانون الثاني للنشاط الإشعاعي.
انظر المثال:
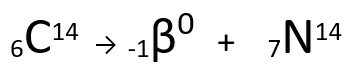
معادلة تمثل انبعاث جسيم β بواسطة الكربون 14.
يمكن ملاحظة أن ذرة النيتروجين المتكونة لها نفس كتلة ذرة C-14 ، أي أنها تساوي الضغطويزداد عددها الذري بوحدة واحدة. الزيادة في العدد الذريأوضحه العالم هنريكو فيرمي، الذي اقترح أن أحد النيوترونات من النواة يخضع لعملية تحويل ، وفقًا للمعادلة التالية ، مولِّدًا أإلكترون(جسيم بيتا المنبعث) ، أ نيوترينو(جسيم دون ذري بدون شحنة كهربائية ولا كتلة) و أ بروتون(ف).
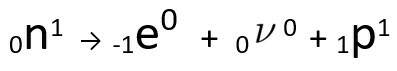
معادلة تمثل التحول النيوتروني ، وفقًا لفرضية فيرمي.
ا إلكترون انها ال نيوترينو يتم إصدارها إلى خارج القلب, متبقي فقط البروتون، وهو ما يفسر الزيادة في العدد الذري لمعرفة المزيد عنها ، انتقل إلى: القانون الثاني للنشاط الإشعاعي أو القانون الثاني للسودي.
اقرأ أيضا: الفرق بين التلوث الإشعاعي والتشعيع
التطبيقات
على الرغم من رأي سلبي تلك الرواسب على النشاط الإشعاعي تطبيقات مهمة في حياتنا اليومية ، على سبيل المثال ، في انتاج كهرباءفي محطات الطاقة النووية عبر الانشطار النوويمن الذرات المشعة.
حاليًا ، لا تستخدم البرازيل امتداد الطاقة النووية كمصدر رئيسي للطاقة ، ولكن لديها محطات للطاقة النووية (أنجرا 1 و 2) تعمل على توفير الكهرباء للبلاد. يمكننا أيضا أن نذكر ال المواعدة المادية وجدها علماء الآثار باستخدام الكربون 14.

محطة ريو دي جانيرو للطاقة النووية ، البرازيل
دور أساسي آخر للنشاط الإشعاعي مرتبط بمجال الطب ، مثل فحوصات الأشعة السينيةوفي الأشعة المقطعية، وكذلك في بعض أنواع معالجة السرطان.
اقرأ أيضا: المخاطر الرئيسية لتوليد الطاقة النووية على البيئة
النشاط الإشعاعي الطبيعي
يوميا نحن مكشوف ال كميات صغيرة من الإشعاع ، سواء كانت صناعية أو طبيعية. يحدث النشاط الإشعاعي الطبيعي تلقائيًا في الطبيعة. يأتي جزء من هذا الإشعاع الذي نتلقاه من الأطعمة التي نستهلكها يوميًا ، مثل الرادون -226 والبوتاسيوم -40 ، والتي يتم تقديمها في مستويات منخفضة للغاية ولا تشكل مخاطر على صحتنا أو تضر بالقيم الغذائية للأطعمة.
تهدف عملية تعريض الطعام للانبعاثات المشعة إلى الحفاظ على الطعام والترويج أ نمو النبات. بعض الأمثلة على الأطعمة التي ينبعث منها الإشعاع هي: جوز برازيلي, موزوالفاصوليا واللحوم الحمراء وغيرها.
اكتشاف
بدأت دراسة النشاط الإشعاعي بالبحث الذي أجراه الفيزيائي الألماني فيلهلم روينتجن، في عام 1895 ، عندما كان يحقق في تأثيرالتلألؤ. عالم آخر مهم لتطوير النشاط الإشعاعي كان الفيزيائي الفرنسي أنطوان هنري بيكريل، الذي لاحظ ، في عام 1896 ، علامات تم وضعها على فيلم فوتوغرافي بواسطة عينة من ملح اليورانيوم.
ومع ذلك ، كان زوجان كوري الذين استخدموا مصطلح النشاط الإشعاعي لأول مرة. في 1898، البولندية ماري كوري واصلت الدراسات حول النشاط الإشعاعي وحققت اكتشافات قيمة للمنطقة ، مثل اكتشاف عنصرين مشعين جديدين: البولونيوم (Po) والراديوم (Ra).
خلفيا، إرنست رذرفورد اكتشف إشعاع ألفا من نوع (α) وبيتا (β) ، مما أتاح تفسيرات أفضل لنموذجها الذري ، فضلاً عن تقدم البحث المتعلق بالنشاط الإشعاعي.
اقرأ أيضا:ماري كوري: السيرة الذاتية والمساهمات والإرث
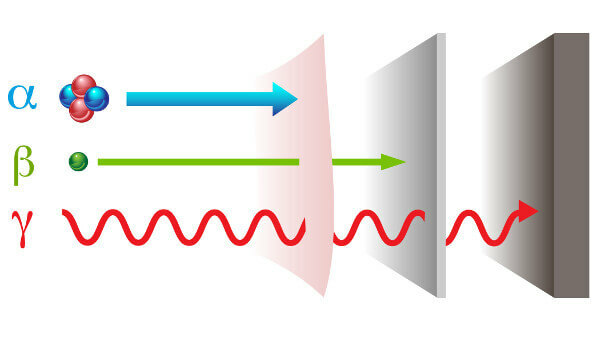
أنواع الإشعاع وقوة اختراقها.
تسوس
ا الاضمحلال الإشعاعي (أو التحويل) هو عملية طبيعية أين واحد قلب غير مستقر ينبعث منها إشعاع ، على التوالي، بغرض خفض طاقتك وتصبح مستقرة.
يحدث هذا عادة مع ذرات العدد الذري. أكبر من 84، وهي ذرات ذات عدم الاستقرار العالي نووي بسبب كمية الشحنة الموجبة (البروتونات) المتراكمة في النواة. في هذه العملية ، النيوترونات ليست كافية لتثبيت جميع البروتونات المتجمعة في النواة ، ثم تبدأ النواة في الخضوع للاضمحلال الإشعاعي حتى يصبح عددها الذري أقل من 84.
في بعض الحالات ، قد يحدث أن تحتوي الذرات التي يقل عددها الذري عن 84 على نوى غير مستقرة وأيضًا تمر بعملية الاضمحلال ، ولكن من أجل ذلك يجب أن يكون لديهم عدد من البروتونات أعلى بكثير من عدد النيوترونات.
الاضمحلال الإشعاعي هو محسوبة بنصف العمر (أو فترة شبه التفكك ، P) من النظائر المشعة، وهو الوقت اللازم لتفكك نصف كتلة العينة المشعة الأولية ، أي لتصبح مستقرة. من الناحية التخطيطية ، يتم تمثيل مفهوم نصف العمر أدناه. لأنه هو عملية مستمرةيميل المنحنى للوصول صفر.
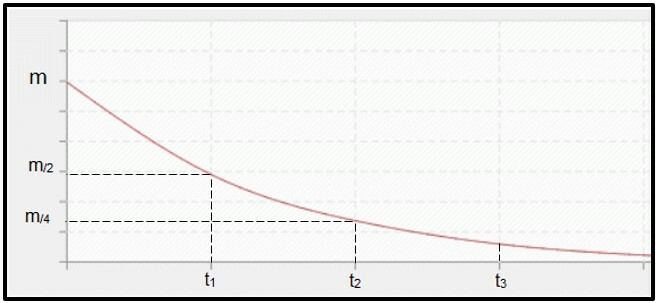
رسم بياني يمثل فترة عمر النصف.
تتبع الحسابات التي تتضمن التحلل الإشعاعي الصيغ التالية:
معادلة حساب الكتلة المتبقية بعد عمر النصف:
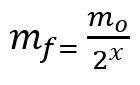
مF - الكتلة النهائية
ما - الكتلة الأولية
x - مقدار نصف العمر المنقضي
معادلة حساب زمن تفكك عينة مشعة:
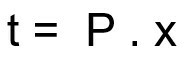
ر - وقت التفكك
ف - فترة نصف العمر
x - مقدار نصف العمر المنقضي
العناصر المشعة
هناك نوعان من العناصر المشعة: أنت طبيعي و ال مصطنع. العناصر الطبيعية لها عناصر موجودة في الطبيعة ، بالفعل مع النوى غير المستقرة ، مثل اليورانيوميا الأكتينيوم انها ال مذياع. تنتج العمليات الاصطناعية عن طريق عمليات تزعزع استقرار نواة الذرة. في هذه الحالة ، يمكننا أن نذكر أستاتين انها ال فرانسيوم.
العناصر المشعة الرئيسية هي: اليورانيوم 235 ، الكوبالت 60 ، السترونشيوم 90 ، الراديوم 224 واليود 131. نظرًا لاستخدامها الواسع في محطات الطاقة النووية وعلاجات السرطان ، تميل هذه العناصر إلى الظهور بشكل متكرر في حياتنا اليومية. لمعرفة المزيد حول هذا الموضوع ، انتقل إلى: العناصر المشعة.
القمامة المشعة
النفايات المشعة أو النفايات النووية انها ال بقايا التابع الصناعات التي تستخدم المواد المشعة في عملياتها التي لم تعد لها تطبيقات عملية. تأتي هذه القمامة بشكل أساسي من محطات الطاقة النووية من تطبيقات طبية.
كان الإنتاج الكبير للنفايات المشعة أ مشكلة بيئية للعالم كله بسبب الندرة وعدم الملاءمة شروط التخلص والتخزين.
ترتبط هذه المخلفات بتلوث التربة والمجاري المائية والهواء ، مما يؤدي إلى تدمير البيئة تدريجيا. بالإضافة إلى ذلك ، فإنها تشكل أيضًا مخاطر على صحة الإنسان ، مثل الالتهابات, سرطان وفي حالات التلوث الشديدة ، يمكن أن تؤدي إلى الموت.
تمارين حلها
(PUC-Camp-SP) القنبلة الذرية ، التي تسمى أيضًا القنبلة النووية ، تحتوي على ذرات يورانيوم 235 كمكون انشطاري ، ، بواعث جسيمات ألفا
، بواعث جسيمات ألفا  . كل ذرة من اليورانيوم 235 ، عند انبعاث جسيم ألفا ، تتحول إلى عنصر آخر ، العدد الذري يساوي
. كل ذرة من اليورانيوم 235 ، عند انبعاث جسيم ألفا ، تتحول إلى عنصر آخر ، العدد الذري يساوي
أ) 231.
ب) 233.
ج) 234.
د) 88.
هـ) 90.
قالب: عندما تصدر ذرة جسيم ألفا ، يحدث انخفاض بمقدار وحدتين في العدد الذري ، وفقًا للقانون الأول للنشاط الإشعاعي. لذلك: 92-2 = 90. الحرف هـ.
(PUC-Camp-SP) اليود 125 ، وهو نوع مشع من اليود مع تطبيقات طبية ، له عمر نصف 60 يومًا. كم جرام من اليود 125 سيبقى بعد ستة أشهر ، بناءً على عينة تحتوي على 2.00 جم من النظائر المشعة؟
أ) 1.50
ب) 0.75
ج) 0.66
د) 0.25
هـ) 0.10
قالب: أولاً ، يتم حساب عدد فترات نصف العمر المنقضية خلال 180 يومًا:
ر = P. x
180 = 60. x
س = 3
بمجرد العثور على عدد فترات نصف العمر المنقضية ، يتم حساب الكتلة التي ستبقى في نهاية 180 يومًا:
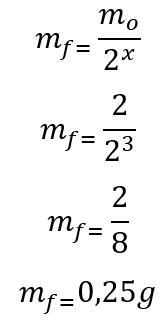
لذلك ، سيبقى 0.25 جم من النظائر المشعة لليود 135 في نهاية الأشهر الستة. الحرف د.
بقلم فيكتور فيليكس
تخرج في الكيمياء

