تسمى الكمية الديناميكية الحرارية غير قادر علي، يرمز لها بالحرف س، ويرتبط ل درجة تنظيم النظام. كلما زاد الاضطراب في النظام ، زاد الانتروبيا.
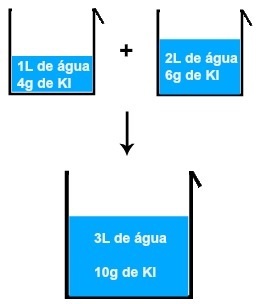
على سبيل المثال ، تخيل أننا نضع كلوريد الصوديوم (NaCl) في الماء. ما يحدث هو تفككها الأيوني ، وإطلاق الأيونات في الماء ، كما هو موضح أدناه:
1 كلوريد الصوديوم(س) → 1 بوصة+(هنا) + 1 سل-(هنا)
لاحظ أن مولًا واحدًا من جزيئات الملح ينتج عنه 2 مول من الأيونات المنفصلة. الأيونات الموجودة في المحلول غير منظمة أكثر من تلك الموجودة في المادة الصلبة ، مما يعني أن إنتروبيا هذا النظام قد زادت.
ال تباين الانتروبيا ، ∆S ، يقاس بـ:

إن إنتروبيا واضطراب النظام له علاقة بعفوية العمليات الفيزيائية. إذا زاد الانتروبيا والاضطراب ، فهذا يعني أن العملية عفوية. على سبيل المثال ، ضع في اعتبارك سقوط زجاج ، فهذه عملية عفوية ، حيث يزداد اضطراب النظام. العملية المعاكسة ، أي صعود شظايا الزجاج واستعادتها ، لا تحدث ، وهي ليست تلقائية ولا رجوع فيها.

حالة أخرى هي سقوط المياه من السدود ، وهي عملية عفوية. في هذه الحالة يمكننا أن نستنتج أن الانتروبيا تزداد. ومع ذلك ، فإن المياه العائدة من تلقاء نفسها إلى قمة السد ليست تلقائية ، وستكون هناك حاجة إلى إجراء خارجي ، مثل مضخة مياه لإنجاز ذلك. وإذا كان ذلك ممكنًا ، فإن الانتروبيا ستنخفض.
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
لذلك، في أي عملية طبيعية تزداد إنتروبيا الكون أو النظام دائمًا.
يمكن أيضًا قياس تباين الانتروبيا ، في أنظمة متساوية الحرارة (من نفس درجة الحرارة) بالمعادلة التالية:

على ماذا:
ماذا او مامراجعة = الطاقة عكسية كحرارة ؛
T = درجة الحرارة.
نظرًا لأن التباين في الانتروبيا يتناسب طرديًا مع درجة الحرارة ، فلدينا ذلك في درجات الحرارة المنخفضة ، سيكون الفوضى أقل ، والعكس صحيح
هناك طريقة أخرى لحساب التباين في الانتروبيا وهي ربطها بالحرارة:

التباين في الانتروبيا يتناسب طرديًا مع التباين في الطاقة ، ويتم الحصول على هذه التناسب من خلال درجة الحرارة T.
وفقًا للورد كلفن (ويليام طومسون ، 1824-1907) ، من المستحيل بناء آلة حرارية فيها يتم استخدام كل الحرارة من المصدر بالكامل في العمل ، أي أن محصوله لن يكون أبدًا 100%. الطاقة التي تتبدد على شكل حرارة تتحول إلى إنتروبيا ، مما يزيد من الفوضى في النظام.
لدينا إذن أن الزيادة في الإنتروبيا مهمة جدًا ، لأنه بدونها لن يحدث شيء ، فهي مسؤولة عن حدوث الظواهر. يرتبط هذا بمعنى كلمة "إنتروبيا" ، والتي تأتي من اليونانية en، وهو ما يعني "في" و يتعثر وهو "التغيير".
بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "غير قادر علي"؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/entropia.htm. تم الوصول إليه في 28 يونيو 2021.