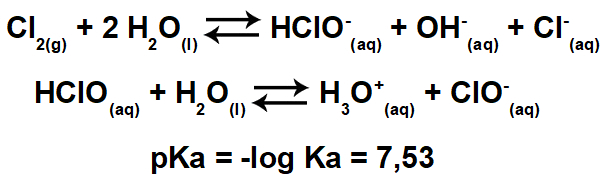مبدأ Le Chatelier: عندما يتم تطبيق قوة على نظام في حالة توازن ، فإنها تميل إلى إعادة ضبط نفسها من أجل تقليل تأثيرات تلك القوة.
التغيرات في الحموضة والقاعدية تعمل كقوى خارجية على التوازنات الكيميائية. يحتاج النظام بعد ذلك إلى التحرك للتخفيف من آثار هذه القوة. لنلقِ نظرة على مثال لعامل يمكنه تغيير توازن النظام ، التركيز.
2 كرو2-4 (عبد القدير) + 2 ح+(هنا) ↔ CrO2-7(هنا)+ ح2ا (1)
إذا أضفنا بضع قطرات من الليمون (المحلول الحمضي) في هذا الميزان ، فسوف ينتقل إلى اليمين أو اليسار ويفضل تكوين أحد المنتجات.
هذا لأنه من خلال هذا الإجراء نزيد كمية H + أيونات في أحد أعضاء المعادلة. إذا حدث هذا في المواد المتفاعلة على اليسار ، يتحول الميزان إلى اليمين ليوازن نفسه.
يمكن عكس التفاعل إذا أضفنا محلول NaOH أساسي إلى النظام. يستهلك وجود OH- أيونات أيونات H + ويتحول التوازن إلى اليسار.
الخلاصة: عند تركيز الأيونات (CrO2-7) يسود ، يتحول الميزان إلى اليسار. إذا كان تركيز الأيونات (CrO 2-4) تسود ، يتحول الميزان إلى اليمين.
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
بقلم ليريا ألفيس
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "مبدأ Le Chatelier" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/principio-le-chatelier.htm. تم الوصول إليه في 28 يونيو 2021.