بطارية هو جهاز يتم فيه إنتاج تيار كهربائي من طاقة كيميائية قادمة من أ تفاعل الأكسدة، أي أن أحد أنواع المواد المتفاعلة يفقد الإلكترونات (الأكسدة) ، بينما يكتسب نوع آخر الإلكترونات (الاختزال).
انظر تمثيلات الأكسدة وتفاعلات الاختزال التي تحدث في أي كومة:
أكسدة: X → و + X+
تفقد الأنواع X إلكترونًا وتتحول إلى كاتيون.
تخفيض: ص- + و → ص
أنيون ص- يكتسب الإلكترون ويتحول إلى نوع Y محايد.
المكونات الأساسية للمكدس
المكونات الأساسية للمكدس هي:
الأنود: القطب السالب الذي يحدث فيه تفاعل الأكسدة ، أي فقدان الإلكترونات ؛
الكاثود: القطب الموجب الذي يحدث فيه تفاعل الاختزال ، أي كسب الإلكترون ؛
المحلول الالكتروليتي (جسر الملح) أو مادة موصلة (مثل شريط الجرافيت): هو الوسيلة التي تصل بها الإلكترونات التي يتركها الأنود إلى القطب السالب.
أساسيات كيفية عمل البطارية
يحدث عمل المكدس من الأحداث التالية:
المبدأ الأول: أكسدة الأنود
يصبح المعدن الموجود في الأنود كاتيونًا ، نظرًا لأنه يميل بشكل أكبر إلى فقد الإلكترونات ، كما لاحظنا في المعادلة أدناه:
Zn → Zn2+ + 2 و
المبدأ الثاني: تخفيض الكاثود
الكاتيونات التي هي جزء من المادة الموجودة في الكاثود (سنستخدم النحاس كمثال) ، عند الاستلام تتحول الإلكترونات من الأنود إلى نحاس معدني ، كما نرى في المعادلة أدناه:
الحمار2+ + 2e → نحاس
أول أكوام
أ) بطارية أليساندرو فولتا
تم تشكيل ظهر كومة أليساندرو (أول كومة في التاريخ) ، تم تجميعها في عام 1800 ، بواسطة أقراص معدنية مقسمة ، كما في الصورة أدناه:

تجميع مماثل لظهر أليساندرو إلى كومة الخاص بك
تم تشذير الأقراص لأن لها تكوينًا مختلفًا. كان أحدهما مصنوعًا من معدن الزنك ، والآخر مصنوعًا من النحاس ، ويتم فصله دائمًا بقطن منقوع في محلول ملحي (محلول يتكون من الماء والملح).
ب) كومة دانييل
تتكون كومة دانييل ، التي تم تجميعها في عام 1836 ، من خليتين نصفيتين متصلتين بسلك موصل وجسر ملح.
نصف خلية 1: كان الأنود ، أي القطب السالب للبطارية.
كانت مكونة من صفيحة من الزنك ، وتم غمر جزء من هذه اللوحة في محلول مكون من الماء وكبريتات الزنك (ZnSO).4).
نصف خلية 2: كان الكاثود ، أي القطب الموجب للبطارية.
كانت مكونة من صفيحة نحاسية ، وتم غمر جزء من هذه اللوحة في محلول مكون من الماء وكبريتات النحاس (CuSO).4).
جسر الملح
أنبوب على شكل حرف U يحتوي على محلول يتكون من الماء وكلوريد البوتاسيوم (KCl) ، والذي يربط نصف خليتين (الزنك والنحاس) وله صوف زجاجي في كلا الطرفين.
البطاريات حاليا
يوجد حاليًا العديد من نماذج المداخن ، لكنها بشكل عام تبدو كما يلي:
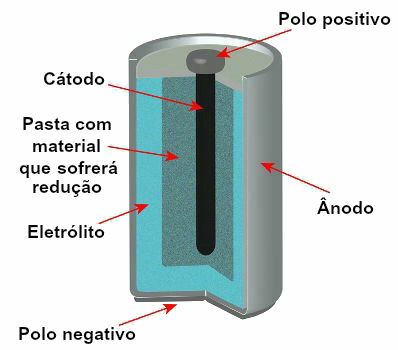
رسم تخطيطي يمثل نموذج المكدس الحالي
أكثر النماذج استخدامًا هي ما يسمى ببطارية Leclanché والبطارية القلوية ، والتي لها الاختلافات التالية:
ال) Leclanche كومة
لها أنود يتكون من الزنك المعدني ؛
له كاثود يتكون من عجينة مع كلوريد الأمونيوم والماء والنشا وثاني أكسيد المنغنيز.
يحتوي على شريط من الجرافيت يعمل كموصل للإلكترونات التي تنطلق من الكاثود باتجاه الأنود.
ب) بطارية قلوية
له أنود يتكون من معدن الزنك أو الكادميوم.
له كاثود يتكون من أكسيد الزئبق وأكسيد النيكل واليود ؛
يجب أن يحتوي على قاعدة مختلطة في المادة التي يتكون منها الكاثود.
بي ديوغو لوبيز دياس
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-pilha.htm

