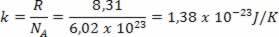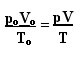الغاز والبخار
يُعطى الفرق بين الغاز والبخار من درجة الحرارة الحرجة. البخار هو مادة في حالة غازية ، وهي حالة يمكن تسييلها مع زيادة الضغط. الغاز ليس هو نفسه. إنه سائل لا يمكن تسييله بزيادة بسيطة في الضغط. هذا يجعل الغاز مختلفًا عن البخار.
سلوك الغازات
المادة المعينة في الحالة الغازية هي غاز إذا كانت درجة حرارته أعلى من درجة الحرارة الحرجة ، إذا كانت درجة الحرارة مساوية أو أقل من درجة الحرارة الحرجة ، فإن المادة عبارة عن بخار.
الغازات الحقيقية التي نعرفها عادة ، مثل الهيليوم والنيتروجين والأكسجين ، لها خصائص جزيئية مختلفة ومحددة لكل منها. ومع ذلك ، إذا وضعناهم جميعًا في درجات حرارة عالية وضغوط منخفضة ، فإنهم يبدأون في إظهار سلوك مشابه جدًا. في دراسة الغازات ، تم اعتماد نموذج نظري بسيط ، وهو غير موجود عمليًا ، مع سلوك مشابه لسلوك الغازات الحقيقية. يتحسن هذا التقريب مع انخفاض الضغط وارتفاع درجة الحرارة. يسمى نموذج الغاز هذا غاز مثالي.
حوالي القرنين السابع عشر والتاسع عشر ، قام ثلاثة علماء (جاك تشارلز ، لويس ج. جاي لوساك وبول إي. Clayperon) ، بعد دراسة سلوك الغازات ، وضع قوانين تحكم سلوك الغازات المثالية ، وتسمى أيضًا الغازات المثالية. تحدد القوانين التي يحددونها قواعد السلوك "الخارجي" للغاز المثالي المؤدي إلى يحسب فقط الكميات الفيزيائية المرتبطة بها ، وهي: الحجم ودرجة الحرارة و الضغط.
القانون العام للغازات الكاملة
يمكن رؤية التعبير الذي يحدد القانون العام للغازات المثالية على النحو التالي:
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
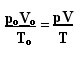
أين صا، الخامسا و تا هي الضغط الأولي والحجم الأولي ودرجة الحرارة الأولية ، على التوالي. يُستخدم هذا التعبير عند اختلاف متغيرات الغاز.
قانون بويل
كان روبرت بويل ، الفيزيائي والكيميائي ، هو من حدد القانون الذي يحكم التحولات التي يمر بها الغاز ، عندما تظل درجة حرارته ثابتة. يقول قانونه أنه عندما يخضع الغاز لعملية تحويل متساوي الحرارة ، فإن ضغطه يتناسب عكسياً مع الحجم المشغول. من هذا القانون نحصل على هذا كيف تيا = ت يجب علينا:
صاالخامسا = الكهروضوئية
قانون تشارلز
قانون تشارلز هو القانون الذي يحكم تحويلات الغاز المثالي إلى حجم ثابت. تسمى هذه التحولات بتحولات متساوية أو متساوية القياس. وفقًا لهذا القانون ، عندما تخضع كتلة الغاز المثالية لعملية تحول متساوي الصدور ، فإن ضغطها يتناسب طرديًا مع درجة حرارتها المطلقة. رياضيا يمكن التعبير عن هذا القانون على النحو التالي:

أين صا و تا هي الضغط الأولي ودرجة الحرارة الأولية على التوالي.
قانون جاي لوساك
قانون جاي لوساك هو القانون الذي يحكم تحولات الغاز المثالي تحت ضغط مستمر. هذا القانون ، على الرغم من أنه يحمل اسم Gay-Lussac ، تم اكتشافه بالفعل من قبل الفيزيائي والكيميائي إيه سي تشارلز. وفقًا للقانون ، عندما يخضع الغاز لعملية تحويل متساوي الضغط ، فإن حجم الغاز يتناسب طرديًا مع درجة حرارته المطلقة. رياضيا يمكن التعبير عن هذا القانون على النحو التالي:

حيث Vا و تا تتوافق على التوالي مع الحجم الأولي ودرجة الحرارة الأولية.
بقلم ماركو أوريليو دا سيلفا
شاهد المزيد!!
تحولات الغاز
اعرف ما هي تحويلات الغاز.
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
سانتوس ، ماركو أوريليو دا سيلفا. "دراسة الغازات" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. تم الوصول إليه في 27 يونيو 2021.