من المهم جدًا في المختبرات والصناعات الكيماوية معرفة كمية المواد المتضمنة في التفاعلات. لذلك ، فيما يلي سوف نتعامل مع المفاهيم والكميات ووحدات القياس الرئيسية المتعلقة بكتل الذرات:
- وحدة الكتلة الذرية (ش):
الذرة المرجعية القياسية للوزن لتعيين وحدة الكتلة الذرية هي الكربون 12 (12ج). وحدة الكتلة الذرية (1 ش) تقابل القيمة 1.66054. 10-24 g ، وهي كتلة 1/12 من نظير الكربون وكتلة تساوي 12 (12ج).
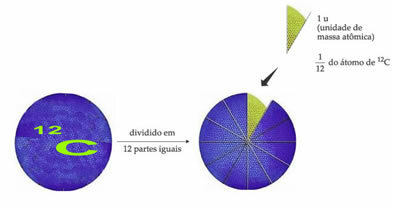
وحدة الكتلة الذرية (ش) هي الوحدة المستخدمة في جميع الكميات المدرجة أدناه.
- الكتلة الذرية للذرة أو النظير (MA):
يتم الحصول عليها بمقارنتها بالقيمة المرجعية المذكورة في البند السابق. على سبيل المثال ، الكتلة الذرية 919تُعطى F بواسطة مطياف الكتلة ، وهو ما يساوي 18.9984 ش. بالتقريب ، يساوي 19 ، وهي نفس قيمة الرقم الكتلي (أ). هذه القيمة تعني الكتلة الذرية للعنصر 919F أكبر 19 مرة من كتلة 1/12 من 12ج.
- الكتلة الذرية للعنصر (AM):
يتم تحديد الكتلة الذرية للعنصر من خلال المتوسط المرجح للكتل الذرية لنظائره. يتم ذلك عن طريق ضرب الكتل الذرية لكل نظير في النسبة المئوية التي تظهر في تكوين العنصر. ثم يتم جمع هذه القيم ، والتي يتم تقسيمها على 100 ، مما ينتج عنه النسبة المئوية الإجمالية.
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
على سبيل المثال ، يتكون عنصر النيون من ثلاثة نظائر بالكتل الذرية التالية والنسب المئوية في تركيبها:

حساب الكتلة الذرية (MA) لهذا العنصر:
سيئنيون = (20. 90,92) + (21. 0,26) + (22. 8,82)
100
سيئنيون = 20179 ش
- الكتلة الجزيئية (مم):
كما يوحي الاسم ، يتم استخدامه للمواد الجزيئية ، أي الذرات المرتبطة من خلال مشاركة أزواج من الإلكترونات ، والتي تسمى الروابط التساهمية.
يتم الحصول على الكتلة الجزيئية بضرب عدد ذرات كل عنصر في كتلتها الذرية وجمع النتائج.
على سبيل المثال ، جزيء ثاني أكسيد الكربون2 يحتوي على كربون واحد واثنين من الأكسجين ، لذلك سنضرب الكتلة الذرية للكربون في 1 ؛ والأكسجين بمقدار اثنين ، وإضافتهم لاحقًا:
ممثاني أكسيد الكربون = (1. سيئج) + (2. سيئا)
ممثاني أكسيد الكربون = (1. 12) + (2. 16)
ممثاني أكسيد الكربون = 12 + 32
ممثاني أكسيد الكربون = 44 ش
- صيغة الكتلة:
إنه نفس الحساب الذي يتم إجراؤه للكتلة الجزيئية للمركبات الأيونية. في هذه الحالة ، يكون الاسم مختلفًا ، لأنه لا يتم تجميعها في جزيئات ، ولكن في مجموعات من الأيونات. نظرًا لعدم وجود الجزيئات ، من الواضح أنه لا معنى للحديث عن الكتلة الجزيئية ، ولكن السبب وراء الحساب هو نفسه.
مثال:
كلوريد الصوديوم
↓ ↓
23 +35.5 ← كتلة الصيغة = 58.5 ش
بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "كتل الذرات" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/massas-dos-atomos.htm. تم الوصول إليه في 28 يونيو 2021.



