ا كلوريد الصوديوم (ملح الطعام) هو الملح الذي نستخدمه في حياتنا اليومية لملح الأطعمة المصنوعة يدويًا أو المعالجة (الصناعية). إنها مادة موجودة أيضًا في العديد من الأطعمة الطبيعية التي نستهلكها يوميًا ، مثل الفواكه والخضروات والبقوليات والبذور ، إلخ.
في هذا النص ستعرف كل شيء عن هذه المادة المهمة لحياة الإنسان اليومية:
التعريف
ينتمي كلوريد الصوديوم إلى الوظيفة غير العضوية للأملاح ويتكون من اتحاد كاتيون الصوديوم (Na+) انها ال أنيون جهناكأوريتو (Cl-) من خلال أ الرابطة الأيونية.
ب) الخصائص الكيميائية
يتكون كلوريد الصوديوم من عنصرين كيميائيين:
→ الصوديوم (نا):
ينتمي إلى عائلة المعادن (القادرة على تكوين الكاتيونات بسهولة) القلوية (AI) ؛
لديه إلكترون في غلاف التكافؤ ؛
له عدد ذري يساوي 11 ؛
لديه القدرة الكهربية العالية (القدرة على فقدان الإلكترونات).
→ الكلور (Cl)
ينتمي إلى عائلة الهالوجينات (VIIA) ؛
إنه مادة غير معدنية (ولهذا السبب يصبح أنيونًا بسهولة) ؛
لديه سبعة إلكترونات في غلاف التكافؤ ؛
له عدد ذري يساوي 17 ؛
لديه قدرة كهربائية عالية (القدرة على اكتساب الإلكترونات).
نظرًا لأن العنصرين الكيميائيين اللذين يشكلان كلوريد الصوديوم ، يوجدان ، على التوالي ، موجبة كهربائية عالية وعالية الكهربية ، بينهما رابطة أيونية (تنشأ بين الذرات مع ميل إلى الخسارة والكسب الإلكترونات).
يتكون التركيب الكيميائي لكلوريد الصوديوم من أنيون كلوريد واحد (كرة خضراء) ، والذي يتفاعل مع ستة كاتيونات الصوديوم (كرات زرقاء) ، كما يتضح من الهيكل أدناه:
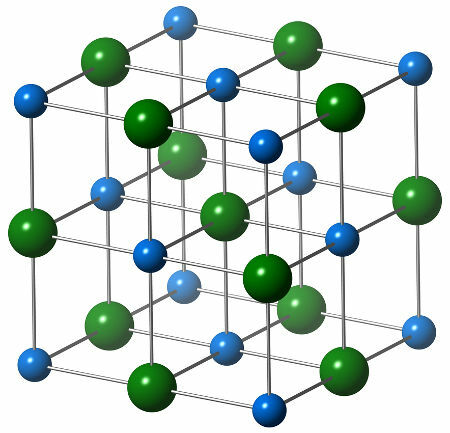
تمثيل التركيب البلوري لكلوريد الصوديوم
ج) الخصائص الفيزيائية
نقطة الانصهار:
يمكن تحويل كلوريد الصوديوم من الحالة الصلبة إلى الحالة السائلة عند درجة حرارة 801 اج.
نقطة الغليان:
يمكن تحويل كلوريد الصوديوم من الحالة السائلة إلى الحالة الغازية عند درجة حرارة 1465 اج.
قطبية
نظرًا لأنها مادة نشأت عن رابطة أيونية ، أي لأنها مركب أيوني ، فإن كلوريد الصوديوم قطبي.
الذوبان في الماء
يمكننا أن نذوب في 1 لتر من الماء ، عند 25 اC ، ما يصل إلى 359 جرامًا من كلوريد الصوديوم.
الذوبان في المذيبات الأخرى:
نظرًا لأن كلوريد الصوديوم مركب قطبي ، فلا يمكن إذابته في أي مذيب ذي طبيعة غير قطبية ، مثل الزيت.
كثافة:
تبلغ كثافة كلوريد الصوديوم 2.165 جم / مل ، لذلك فهو أكثر كثافة من الماء الذي تبلغ كثافة كلوريد الصوديوم 1 جم / مل.
التوصيل الكهربائي:
نظرًا لأنه مركب أيوني ، فإن كلوريد الصوديوم قادر على توصيل تيار كهربائي فقط عندما:
-
إنه في حالته المنصهرة ، أي سائل ؛
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
مذاب في الماء.
د) طرق الحصول عليها
يمكن الحصول على كلوريد الصوديوم ماديًا أو كيميائيًا:
1ا) الحصول على الجسدية:
التبلور الجزئي
يتم الحصول على كلوريد الصوديوم عن طريق تبخير المياه من المحيطات.
مناجم تحت الأرض
يتم استخراجه في المناجم باستخدام تقنيات التعدين.
رواسب تحت الأرض
يتم استخراجه من الرواسب العميقة تحت الأرض عن طريق إذابته في الماء (يذوب الملح الموجود في الرواسب) ثم الضخ.
2ا) الحصول كيميائيا
تفاعل التوليف
يمكن الحصول على كلوريد الصوديوم من التفاعل الكيميائي للتوليف (المواد البسيطة تؤدي إلى مادة مركبة) بين غاز الكلور والصوديوم المعدني:
2 بوصة(س) + Cl2 (ز) → 2 كلوريد الصوديوم(س)
تفاعل التعادل:
هناك طريقة أخرى للحصول على كلوريد الصوديوم كيميائيًا من خلال تفاعل التعادل بين حمض الهيدروكلوريك وهيدروكسيد الصوديوم ، حيث يكون لدينا تكوين الملح والماء:
حمض الهيدروكلوريك(1) + هيدروكسيد الصوديوم(هنا) → كلوريد الصوديوم(هنا) + ح2ا(1)
هـ) الأهمية للبشر
كلوريد الصوديوم في حد ذاته ليس له وظيفة في جسم الإنسان ، ولكن عندما يتفكك إلى كاتيونات الصوديوم (Na+) وأنيونات الكلوريد (Cl-) ، لكل من هذين الأيونات عدة وظائف مهمة لجسمنا. شاهد بعض هذه الوظائف:
→ وظائف كاتيون الصوديوم (Na+)
يمنع تخثر الدم.
يحارب تكوين حصوات الكلى والمرارة.
يشارك في تنظيم سوائل الجسم.
يشارك في تنظيم ضغط الدم.
→ وظائف أنيون كلوريد (Cl-)
المشاركة في تكوين وتشكيل عصير المعدة (حامض الهيدروكلوريك - حمض الهيدروكلوريك) ؛
المشاركة في تكوين عصير البنكرياس.
و) الأضرار التي تلحق بجسم الإنسان
الاستهلاك المفرط لكلوريد الصوديوم يمكن أن يسبب الضرر التالي للإنسان:
← الأضرار التي تسببها كاتيونات الصوديوم الزائدة في الجسم:
زيادة وقت التئام الجروح.
زيادة حدوث تشنجات;
ارتفاع ضغط الدم.
فرط الكلى.
زيادة احتباس السوائل في الجسم.
← الضرر الناجم عن زيادة الكلوريد في الجسم:
تدمير فيتامين هـ;
انخفاض في إنتاج اليود في الجسم.
ز) تطبيقات أخرى
بالإضافة إلى استخدامه لملح الطعام ، يمكن أيضًا استخدام كلوريد الصوديوم في المواقف التالية:
إنتاج الشامبو
إنتاج الورق
انتاج هيدروكسيد الصوديوم (هيدروكسيد الصوديوم) ؛
إنتاج المنظفات
إنتاج الصابون؛
ذوبان الجليد في الأماكن التي تعاني من العواصف الثلجية ؛
إنتاج الصوديوم المعدني ؛
إنتاج غاز الكلور ؛
في الخواص المتوازنة لاستبدال الجسم بالكهرباء ؛
في محاليل احتقان الأنف.
إنتاج محلول ملحي. من بين تطبيقات أخرى.
بي ديوغو لوبيز دياس
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
DAYS ، ديوغو لوبيز. "كلوريد الصوديوم (ملح الطعام)" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/cloreto-sodio.htm. تم الوصول إليه في 27 يونيو 2021.
المركبات الأيونية ، الخصائص الرئيسية للمركبات الأيونية ، الترابط بين الأيونات ، النقل النهائي للإلكترونات ، قوى الجذب الكهروستاتيكية بين الأيونات ، الأيونات السالبة والموجبة ، الأنيونات ، الكاتيونات ، الترابط الأيوني ، التركيب الجزيئي هو
كيمياء

الرابطة الأيونية ، الترتيبات بين المركبات الأيونية ، التكتلات الأيونية ، كلوريد الصوديوم ، ملح الطعام ، المادة الأيونية ، قوى الجذب الكهروستاتيكية ، أنيون الكلوريد ، كاتيونات الصوديوم ، المذيبات القطبية ، الأيونات الموجبة ، الكاتيونات ، الأيونات السالبة ، الأنيونات.