في النص "التركيز في مول / لتر أو مولارية"رأيت أن التركيز في مول / لتر يتعلق بكمية المادة في المذاب (n1, تقاس بالمولات) مع حجم المحلول باللتر (V). ومع ذلك ، هناك بعض المواد المذابة التي ، عند وضعها في الماء ، تولد الأيونات.
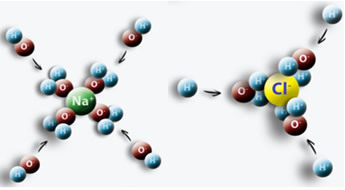
مثال على ذلك هو عندما نضع الملح (NaCl) في الماء ، يحدث تجاذب بين القطب الموجب للماء مع Cl والقطب السالب مع Na ، مما يؤدي إلى ظهور أيونات Na+ و Cl-.
من المهم معرفة كيفية تحديد التركيز في مول / لتر لهذه الأيونات ، حيث يمكن أن يكون ذلك مفيدًا في العديد من المواقف. أحد المجالات التي تستخدم هذا الدواء هو الطب ، وخاصة في فحوصات الدم الطبية. تحتوي دمائنا وسوائل الجسم الأخرى على أيونات مذابة فيها. إذا كان تركيز هذه الأيونات في دمنا أعلى أو أقل من المعدل الطبيعي ، فقد يؤدي ذلك إلى الإضرار بوظائف الجسم بشكل سليم ويؤدي إلى اضطرابات وأمراض.
انظر حالة أيونات الحديد (Fe2+): إذا كان الشخص ينقصه هذا الأيون فقد يصاب بفقر الدم وبالتالي ، عندما يتم إخبار شخص مصاب بفقر الدم أنه يحتاج إلى تناول الأطعمة الغنية بالحديد أو حتى بعض الأدوية التي تحتوي على الحديد ، فهو في الواقع أيون الحديد وليس العنصر المعدني.
حالة أخرى عندما يكون هناك فقدان أيونات الكالسيوم (Ca2+) في العظام مسببة هشاشة العظام كما هو موضح في الصور مع صور مكبرة للعظام أدناه:

انظر إلى أمثلة أخرى للأيونات التي لها وظائف حيوية في أجسامنا وتحتاج إلى التركيز الصحيح:

لذلك ، بالنظر إلى هذه المعلومات ، يصبح من الواضح أن معرفة كيفية حساب تركيز الأيونات في المحاليل أمر مهم حقًا. ولكن كيف يمكن القيام بذلك؟
من الممكن تحديد التركيزات في مول / لتر للأيونات الموجودة في المحاليل في حالة معرفة معطيات أساسية ، وهما:
- صيغ المواد المذابة في الماء ؛
- مولارية الحلول الخاصة بك.
مع وجود هذه البيانات في متناول اليد ، اكتب معادلة التفكك أو التأين للمذاب المعني وابحث عن طريق خصم تركيز الأيونات ، مثل يتناسب مع عدد مولات كل أيون. هذا يعني أن تركيز الأيونات يتناسب مع معاملات كل منها في معادلة التأين أو التفكك.
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
راجع المثال التالي لفهم كيفية إجراء هذا الحساب بشكل أفضل:
"ضع في الاعتبار أن التركيز في كمية مادة محلول مائي معين من فوسفات المغنيسيوم (Mg3(غبار4)2 0.5 مول / لتر. ماذا سيكون التركيز في مول / لتر من كاتيونات المغنيسيوم (Mg2+(هنا)) وأنيونات الفوسفات (PO3-4 (عبد القدير)) في هذا الحل ، مع الأخذ في الاعتبار أن درجة التفكك (α) كانت 100٪؟ "
الخطوة الأولى في حل هذه المشكلة هي كتابة معادلة التفكك أو التأين. إذا كنت تواجه صعوبة ، يمكنك أن تبني نفسك على المعادلة العامة أدناه:
1 أxبذ → س أ+ ص + ص ب-x
1 مول x مول y مول
لذلك ، بالنظر في هذا المثال إلى أن فوسفات المغنيسيوم قد انفصل تمامًا ، لدينا المعادلة التالية:
1 مجم3(غبار4)2 (aq) → 3 ملغ2+(هنا) + 2 جرام3-4 (عبد القدير)
1 مول 3 مول 2 مول
يمكننا أن نرى أن 1 مول من Mg3(غبار4)2 يعطي 3 مول من Mg2+(هنا) و 2 مول من PO3-4 (عبد القدير); وبالتالي ، فإن عدد مولات الكاتيون سيكون 3 أضعاف عدد مولات الفوسفات التي تم تحضير المحلول بها ، وسيكون عدد الأنيونات مرتين.
حيث أن المحلول 0.5 مول / لتر من المغنيسيوم3(غبار4)2 (aq) ، وهذا يعني أنه تم إذابة 0.5 مول من Mg في 1 لتر منها3(غبار4)2مما أدى إلى ارتفاع 1.5 مول / لتر من المغنسيوم2+(هنا) و 1.0 مول / لتر من PO3-4 (عبد القدير):
1 مجم3(غبار4)2 (aq) → 3 ملغ2+(هنا) + 2 جرام3-4 (عبد القدير)
1 مول 3 مول 2 مول
0.5 مول x ص
1. 0,5 3. 0,5 2. 0,5
0.5 مول / لتر 1.5 مول / لتر1.0 مول / لتر
ولكن ماذا لو لم تكن درجة التفكك أو التأين 100٪؟ لنفترض أنها كانت 70٪ ، كيف يمكننا معرفة تركيز مول / لتر لهذه الأيونات؟
في هذه الحالة ، ما عليك سوى تنفيذ قاعدة بسيطة من ثلاثة. انظر أدناه:
1.5 مول / لتر ملغ2+(هنا) 100 %
70٪ ×
س = 70. 1,5 → س = 1.05 مول / لتر من أيونات المغنيسيوم2+(هنا)
100
1.5 مول / لتر من PO3-4 (عبد القدير) 100 %
ص 70٪
ص = 70. 1,0 → ص = 0.70 مول / لتر من أيونات PO3-4 (عبد القدير)
100
بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "تركيز الأيونات في مول / لتر" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/concentracao-dos-ions-mol-l.htm. تم الوصول إليه في 28 يونيو 2021.
كيمياء

التفكك والتأين ، العالم الإيطالي فولتا ، التيار الكهربائي ، الكيميائي الفيزيائي السويدي سفانت أوغست أرهينيوس ، نظرية أرهينيوس ، أيونات موجبة ، كاتيونات ، أيونات سالبة ، أنيونات ، صودا كاوية ، ملح طعام ، جزيئات قطبية ، تفكك أيوني،