THE Теорія октетів стверджує, що для того, щоб атом хімічного елемента був стабільним, він повинен набути електронної конфігурації благородного газу, тобто він повинен мати вісім електронів у валентній оболонці або два електрони, якщо атом має лише першу електронну оболонку. (К).
Атомарний номер берилію дорівнює 4. Отже, ваш атом має 4 електрони, і його електронний розподіл у основному стані визначається:

Берилій електронна конфігурація
Це означає, що в останній оболонці берилію є 2 електрони, які належать до сімейства 2А (лужноземельні метали). Таким чином, він мав би тенденцію віддавати ці два електрони, отримуючи заряд 2+, тобто мав би тенденцію утворювати іонні зв'язки.
Однак спостерігається, що атоми берилію утворюють ковалентні зв’язки з розподілом електронів, як показано в сполуці, що утворюється нижче, гідридом берилію (BeH2):
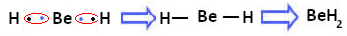
Утворення ковалентних зв’язків берилію з воднем
Зауважимо, що в даному випадку берилій стабільний, маючи у валентній оболонці менше восьми електронів, оскільки поділяють свої електрони, як атоми водню, тепер він має чотири електрони в останньому шар. Отже, це a
виняток з правила октету.Але ковалентний зв’язок зазвичай відбувається, оскільки елемент має неповні орбіталі. Наприклад, як показано нижче, водень має неповну орбіталь, тому він утворює лише один ковалентний зв’язок. Кисень має дві неповні орбіталі і утворює два ковалентні зв’язки. Азот, у свою чергу, має три неповні орбіталі і, отже, утворює три ковалентні зв’язки:
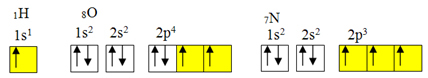
Електронні розподіли водню, кисню та азоту
Однак, як уже було показано, берилій не має неповних орбіталей.
Не зупиняйтесь зараз... Після реклами є ще щось;)
То чому він утворює ковалентні зв’язки?
Пояснення в теорія гібридизації, що говорить про це коли електрон з орбіталі отримує енергію, він "стрибає" на крайню порожню орбіталь, перебування в збудженому стані і, отже, відбувається злиття або змішування неповних атомних орбіталей, генеруючий гібридні орбіталі які еквівалентні один одному і відрізняються від вихідних чистих орбіталей.
Наприклад, у випадку берилію, електрон з підрівню 2s отримує енергію і переходить на порожню орбіталу підрівню 2p:

Збуджений стан берилію для утворення гібридних орбіталей
Таким чином, берилій має дві неповні орбіталі, будучи здатним утворювати два ковалентні зв’язки.
Зверніть увагу, що одна орбіталя знаходиться в підрівні "s", а інша - у "p", тому зв'язки, які б виконував берилій, повинні бути різними. Однак це трапляється не так, оскільки з явищем гібридизація, ці неповні орбіталі, що утворилися, змішаються, породжуючи дві орбіталі, які називаються гібриди або гібридизований, які рівні між собою. Крім того, оскільки ці дві гібридні орбіталі вийшли з орбіталі "s" та орбіталі "p", ми говоримо, що ця гібридизація має тип sp:

Формування гібридизації Beryllium sp
Оскільки гібридні орбіталі однакові, то ковалентні зв’язки, які утворює берилій з атомами водню, також будуть однаковими:

Взаємопроникнення гібридних берилієвих орбіталей з s-орбіталями водню
Зверніть увагу, що тоді він створює два сигма-зв’язки типу s-sp (σs-sp).
Дженніфер Фогача
Закінчив хімію


