Динамічна рівновага або хімічна рівновага реакції виникає, коли пряма і зворотна реакції відбуваються одночасно. Ці так звані оборотні системи представлені стрілками в обох напрямках:  або
або  . Приклад оборотної реакції наведено на зображенні вище, між газом йоду та газом воднем.
. Приклад оборотної реакції наведено на зображенні вище, між газом йоду та газом воднем.
На початку реакції кількість реагентів максимальна, а продуктів - нуль. Однак реагенти реагують між собою, зменшуючи їх концентрацію і збільшуючи концентрацію утворених продуктів. Швидкість розвитку прямої реакції також зменшується.
Зі збільшенням концентрації продуктів починається зворотна реакція, і реагенти знову утворюються; зростає і швидкість розвитку зворотної реакції.
При досягненні хімічної рівноваги при постійній температурі швидкість розвитку прямої та зворотної реакцій рівні.
Всіпрямий = Усі зворотний
Норми однакові, але концентрації - ні. Концентрації реагентів і продуктів навряд чи будуть однаковими. Лише у рідкісних випадках це відбувається. У більшості випадків концентрація реагентів буде вищою, ніж концентрація продуктів або навпаки.
Таким чином, ми маємо три можливі способи графічно представити темпи розвитку прямі та зворотні реакції, що відносяться до концентрацій реагентів та продуктів над час. Давайте розглянемо кожен випадок:
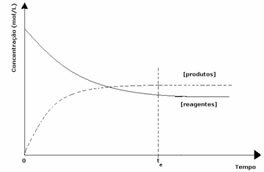
1-й випадок: Рівні концентрації:
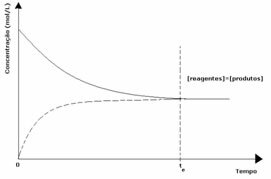
Як видно на графіку, в момент часу tі пряма і зворотна реакції однакові, і в цьому випадку концентрації реагентів і продуктів однакові. Таким чином, рівновага не зміщується в обидві сторони, інтенсивність обох реакцій однакова, як це виражено нижче:
Не зупиняйтесь зараз... Після реклами є ще щось;)
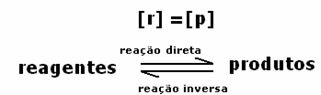
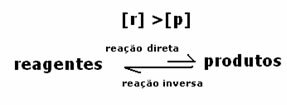
2-й випадок: Концентрація реагентів більша, ніж концентрація продуктів:
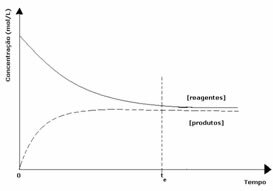
У цьому випадку спостерігається, що при досягненні рівноваги концентрація реагентів перевищує концентрацію продуктів. Таким чином, робиться висновок, що якщо реагенту більше, обернена реакція відбувається з більшою інтенсивністю. Реакція зміщується вліво:
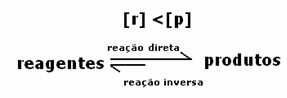
3-й випадок: Концентрація продуктів більша, ніж у реагентів:
Оскільки при рівновазі концентрація продуктів більша, це означає, що реакція є зміщений вправо, оскільки пряма реакція (з утворенням продуктів) відбувається з більшою інтенсивність.
Що вкаже на те, чи прагне реакція праворуч чи ліворуч, буде константа рівноваги К, яка залежить лише від температури.
Дженніфер Фогача
Закінчив хімію
Шкільна команда Бразилії
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
FOGAÇA, Дженніфер Роша Варгас. «Графічне вивчення хімічного балансу»; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm. Доступ 28 червня 2021 року.
Хімія

Перевірте свої знання та дізнайтеся більше за допомогою цього списку розв’язаних вправ на хімічні баланси. Завдяки цьому матеріалу ви зможете краще зрозуміти, як працювати з константами рівноваги (Kp, Kc та Ki), зсувом рівноваги, pH та pOH, а також рівновагою в так званих буферних розчинах.