Американський хімік Гілберт Н. Льюїс (1875-1946) запропонував правило октету, яке говорить:
"Атоми різних елементів встановлюють хімічні зв'язки, віддаючи, приймаючи або ділячись електронами, щоб набути електронної конфігурації благородний газ, тобто з 8 електронами в останній оболонці (або з 2 електронами у випадку тих атомів, які мають лише одну електронну оболонку, як це відбувається з водень) ".
У 1916 р. Льюїс запропонував залишатися стабільним, досягаючи октету або дуету, елементів, що складають молекулярні речовини виконати обмін парами електронів. Ці речовини утворені лише атомами водень, неметали та напівметали, все з тенденція до отримання електронів. Тому жоден з них не може віддавати будь-який електрон (як це відбувається з металами в іонних зв’язках), але кожному потрібно отримувати, тому вони діляться своїми електронами за допомогою ковалентного зв’язку або молекулярний.
Таким чином, Гілберт Льюїс запропонував спосіб представити ковалентний або молекулярний зв’язок, який став відомий як
Формула Льюїса. Її також називають електронна формула чи ще, Електронна формула Льюїса, оскільки його основна характеристика полягає в тому, що вона показує електрони у валентній оболонці кожного атома та утворення електронних пар.Кожен електрон представлений крапкою., який оточує символ відповідного хімічного елемента. Тільки електрони валентної оболонки знаходяться навколо елемента.
Як показано в таблиці нижче, щоб знати кількість електронів у валентній оболонці, просто знайте сімейство Періодичної системи:
Не зупиняйтесь зараз... Після реклами є ще щось;)

У формулі Льюїса кожна спільна електронна пара являє собою хімічний (ковалентний) зв’язок, де електрони стикаються в області електросфери, яка є спільною для кожної пари атомів, які з’єднані між собою. Тому у поданні вони розміщені поруч.
Наприклад, давайте з’ясуємо, що таке формула Льюїса для газоподібного водню, молекулярна формула якого: H2.
Кожен атом водню має лише один електрон у валентній оболонці, оскільки цей елемент належить до сімейства 1 Періодичної системи. Кожен повинен отримати ще один електрон, щоб бути стабільним, з двома електронами в електронній оболонці К. Тож вони діляться своїми електронами і обидва отримують два. Подивіться:
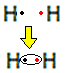
Це формула Льюїса для молекули газоподібного водню.
Кисень має в своїй електронній оболонці шість електронів, тому кожен повинен отримати ще два електрони, щоб бути стабільним, з вісьмома електронами. Отже, формула Льюїса для молекули газоподібного кисню така:

Переконайтеся, що є два посилання, оскільки є дві спільні пари.
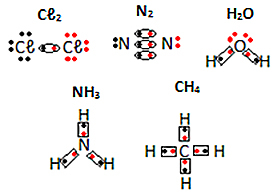
Інші приклади електронних формул молекулярних речовин дивіться нижче:
Дженніфер Фогача
Закінчив хімію
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
FOGAÇA, Дженніфер Роша Варгас. «Льюїс Електронна Формула»; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/formula-eletronica-lewis.htm. Доступ 28 червня 2021 року.
Просторова формула Карбону, електронна формула Льюїса, площинна структура, електронні пари, зв’язок ковалентний, валентний шар, еволюція атомної моделі, молекулярна формула, структурна формула, формули тривимірна.
Хімічні формули, плоска структурна формула, структурна формула Купера, потрійний зв’язок, газ азот, електронна формула, формула Льюїса, молекулярна формула, одинарний зв’язок, подвійний зв’язок, газ вуглекислий.
Хімія
Молекулярні речовини, температура кипіння, поверхня контакту, температура кипіння, сили міжмолекулярного притягання, хімічний зв’язок, молекулярні сполуки, ковалентні хімічні зв’язки, іонні зв’язки, металеві зв’язки, фізичні стани погано



