THE сольовий міст був запропонований англійським хіміком Фредеріком Даніелем у 1836 р., коли цей учений створив акумулятор названий на його честь (Купа Данила). цей міст являє собою П-подібну трубку, яка має два пористих кінця. (що складається з бавовни або агар-агару) і містить водний розчин, утворений водою та сіллю. Він опосередковано з'єднує розчини двох напівклітин клітини (анода та катода).
Спостереження: Анод є негативним полюсом акумулятора, де відбувається окислення, а катод - позитивним полюсом і де відбувається відновлення.
Щоб зрозуміти важливість сольового мосту, спочатку необхідно зрозуміти функціонування палі. Див. Схему нижче:
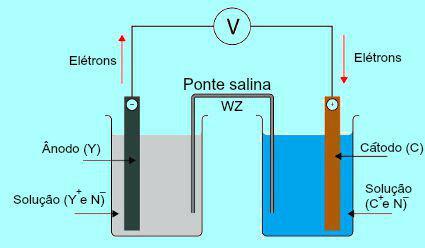
Загальна схема стека Даніеля
Спочатку метал (Y) пластини, присутній в аноді, зазнає окислення. Піддаючись окисленню, метал перетворюється на катіон, який потрапляє в розчин, в якому знаходиться пластина. З цієї причини анодний розчин починає представляти більш високу концентрацію катіонів (Y+). У цьому випадку спостерігається зменшення анодної металевої пластини.
Y → та- + Y+
Потім електрони, втрачені під час окислення металу анодної пластини, проходять через зовнішній електричний провід і спрямовуються до металевої пластини, що знаходиться в катоді. Таким чином, пластинка, яка знаходиться на катоді, заряджається електронами.
-
Дані катіони (C+) в розчині рухаються до катодної пластини, оскільки вона заряджена електронами. Катіони, отримуючи електрони, присутні в пластині, стають нейтральними (стабільними і твердими) і прилипають до неї. З цієї причини катодний розчин має вищу концентрацію аніонів, ніж катіонів. У цьому випадку спостерігається збільшення розміру катодної металевої пластини.
Не зупиняйтесь зараз... Після реклами є ще щось;)
Ç+ + та- → C
З розуміння того, як Купа Даніеля, можна помітити, що розчин, присутній в аноді, отримує більшу кількість катіонів Y+ внаслідок окислення металу X-пластини. Натомість розчин, що знаходиться в катоді, втрачає свої катіони (С+), оскільки вони страждають від зменшення нальоту.
Саме з цього питання висвітлюється робота соляного мосту. Основна функція цього мосту - сприяти рівновазі зарядів, наявних як в анодному, так і в катодному розчині. У сольовому мосту ми завжди маємо сіль (зазвичай хлорид калію або нітрат амонію), дисоційовану у воді. Дивіться подання рівняння в сольовому мосту:
WZ + H2O → W+ + Z-
У сольовому мосту є два іони (W+ та Z-), які зміщуються до катода та анода відповідно до:
The) Анод отримує аніони (Z-), присутній в сольовому мосту через окислення елемента (Y), що спричинює збільшення кількості катіонів (Y+) у розчині.
Б) Катод отримує катіони (W+) сольового мосту, оскільки під час роботи від батареї катіон (C+), присутній у розчині, зменшується на дошці. Таким чином, катодний розчин має більшу кількість аніонів (N-) і тому отримує катіон, присутній у сольовому мосту.
Мені Діого Лопес Діас
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
ДНІ, Діоґо Лопес. «Вітрильний міст»; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/ponte-salina.htm. Доступ 28 червня 2021 року.


