Один реакція додавання - це хімічний процес, при якому до органічної молекули додаються атоми неорганічної речовини, яка повинна мати одну з таких характеристик:
Відкрита структура, що містить зв'язування або пі посилання;
Насичена закрита структура (тільки с посилання сигма);
Закрита ненасичена структура (з пі або ароматичним зв’язком).
Органічні сполуки, що мають ці характеристики, наступні Вуглеводні:
алкени;
Алкіни;
Алкадієни;
Циклани;
Цикли;
Ароматичні.
Під час реакція додавання, одна або декілька пі-зв'язків, або сигма-зв'язок (у виключному випадку циклана) розриваються спричиняючи появу двох або більше вільних валентностей (ділянок склеювання) на залучених вуглецях, як у прикладі нижче:
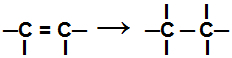
Розривання зв’язку пі в алкені
Після розриву цього зв’язку додавання атомів повинно відбуватися в нових місцях зв’язку, створених в органічній сполуці. Нижче наведено типи реакції додавання що можна проводити з органічними сполуками.
гідрування
У цьому реакція додавання, крім органічної сполуки, іншим реагентом є газоподібний водень (H
2). У кожному з вуглецевих вуглеців, де відбувається поділ (розрив сигма-або пі-зв'язку, як видно раніше), буде зв’язок атома водню, що відноситься до кількості розірваних зв’язків.Наприклад, коли ми проводимо гідрування циклобутану, сигма-зв'язок розривається між вуглецями 1 і 2. Потім атом Гідрогену зв’язується з кожним із цих вуглеводнів:
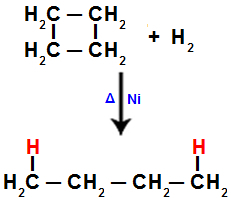
Рівняння, що представляє гідрування в циклобутані
Галогенування
На додаток до органічної сполуки, інший реагент у цьому реакція додавання є молекулярним галогеном (хлор-хлористий газ2, фтор-F газ2, твердий йод-I2 і рідкий бром-Br2). На кожному вуглеці, де відбувається поділ (розрив сигма-або пі-зв'язку, як видно вище), буде зв'язок атома галоген посилаючись на кількість розірваних з'єднань.
Таким чином, коли ми здійснюємо галогенування (з використанням газоподібного хлору) циклопропену, пі-зв'язок розривається між вуглецями 1 і 2. Потім атом хлору зв'язується з кожним із цих вуглеводнів:

Рівняння, що представляє галогенування в циклопропені
Не зупиняйтесь зараз... Після реклами є ще щось;)
Реакція приєднання з галогенідом
Галогенід - це неорганічна гідракислота, утворена атомом водню та атомом водню. галоген, такий як соляна кислота (HCl), плавикова кислота (HF), бромоводнева кислота (HBr), кислота гідройодний (ГІ).
В реакція додавання з галогенідом, крім органічної сполуки, іншим реагентом є галогенід, отже, одне з вуглеводнів, де розщеплення (розрив сигма-або пі-зв'язку, як видно вище), повинен отримати атом водню, а інший - галогенід.
Відповідно з Правління Марковникова, найбільш гідрогенізований атом вуглецю (або вуглець, приєднаний до меншого радикала), повинен отримувати водень, і менш гідрований вуглець (або вуглець, приєднаний до більшого радикала), повинен отримувати галогенід.
Наприклад, коли ми проводимо цю реакцію на пропені з соляною кислотою (HCl), пі-зв'язок розривається між вуглецями 1 і 2. Потім водень пов'язується з вуглецем 1 (більш гідрогенізованим), а хлор - з вуглецем 2 (менш гідрогенізованим):
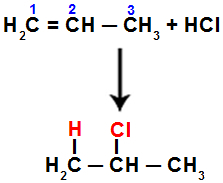
Рівняння, що представляє додавання з галогенідом у пропені
Реакція гідратації
Молекула води при іонізації утворює катіон гідронію (H+) та гідроксид-аніон (OH-). З цієї причини в цьому реакція додавання, крім органічної сполуки, іншим реагентом є вода. Таким чином, один із вуглеців, де відбувається поділ (розрив сигми або пі-зв’язку, як видно вище), отримує катіон гідронію, а інший - аніон гідроксиду.
Згідно з правилом Марковникова, найбільш гідрований атом вуглецю (або вуглець, приєднаний до меншого радикала) повинен отримувати гідроній, а менш гідрований вуглець (або вуглець, приєднаний до більшого радикала), повинен отримувати гідроксид.
Наприклад, коли ми гідратуємо пента-1,4-дієн, пі-зв'язок розривається між вуглеводами 1 і 2 та між вуглеводами 4 і 5. Потім вуглеці 1 і 5 отримують гідроній, а вуглеці 2 і 4 - гідроксид:
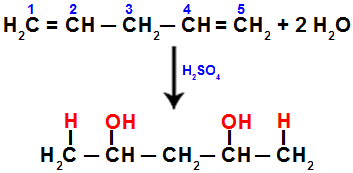
Рівняння, що представляє додавання з гідратацією в пента-1,4-дієні
Мені Діого Лопес Діас
