карбонові кислоти є органічними сполуками, які мають карбоксильну функціональну групу, тобто вуглець, який утворює подвійний зв’язок з киснем і одинарний зв’язок з OH-групою.
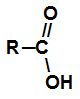
Карбоксил є функціональною групою кожної карбонової кислоти
Термін карбонова кислота використовується для позначення кисневої органічної функції, тобто такої, що має у своїй структурі атом кисню. З'єднання, що належать до цієї групи, мають корозійну здатність і кислий смак, оскільки є кислими.
Характеристика карбонових кислот
Взагалі кажучи, вони розчиняються в органічних розчинниках;
Єдиними карбоновими кислотами, які розчиняються у воді, є ті, що мають у своїй структурі до чотирьох атомів вуглецю;
Загалом, карбонові кислоти щільніші за воду, за винятком кислот з одним або двома атомами вуглецю;
Карбонові кислоти, що містять до дев’яти вуглеводнів, є рідкими при кімнатній температурі;
У твердому стані вони білуваті і мають воскоподібний (восковий) вигляд;
У рідкому стані вони безбарвні;
Оскільки вони мають карбоксил, вони здатні встановити водневі зв’язки;
Його сполуки полярні;
Загалом вони не мають запаху, за винятком кислот із вмістом до трьох вуглеводнів, що мають подразнюючий запах, та тих, що містять до шести вуглеводнів, з огидним запахом;
правило номенклатура карбонових кислот
Для виконання номенклатури a карбонова кислота, Міжнародний союз чистої та прикладної хімії (IUPAC) визначає таке правило:
Кислота
+
префікс (стосується кількості вуглецю в ланцюзі)
+
інфікс (стосується типу зв’язків між атомами вуглецю)
+
Привіт співпраця
Див. Кілька прикладів:
Карбонова кислота з шістьма атомами вуглецю
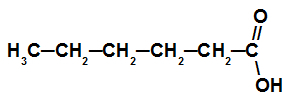
Ця кислота має ланцюг із шістьма атомами вуглецю (префікс hex), лише одинарні зв’язки (infix an) та карбоксил (oic), тому її назва - гексанова кислота.
Карбонова кислота з сімома атомами вуглецю
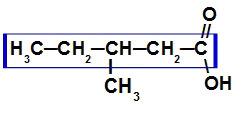
Оскільки ця кислота розгалужена, основною ланцюгом є та, що має найбільшу кількість вуглецю та карбоксилу. У цій сполуці основний ланцюг має п’ять атомів вуглецю (префікс пент), лише одинарні зв’язки між атомами вуглецю (інфікс an) та карбоксилом (oic), тому його назва - кислота 3-метил-пентанової.
ПРИМІТКА: Нумерація основних ланцюгів завжди повинна починатися з карбоксильного вуглецю.
Карбонова кислота з двома карбоксилами
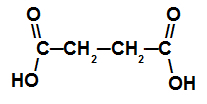
Ця кислота має ланцюг із чотирма атомами вуглецю (префікс, але), лише одинарні зв’язки між атомами вуглецю (інфікс an) та двома атомами карбоксилу (діок), тому його назва - кислота бутандіоєва кислота.
ПРИМІТКА: Між інфіксом та “діоком” було додано сполучну голосну.
Хімічні реакції з карбоновими кислотами
The) реакція етерифікації
Це хімічна реакція, в якій карбонова кислота реагує з алкоголь і формують одне складний ефір і вода, як показано в наступному рівнянні:

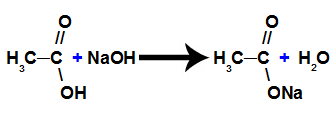
б) Реакція виділення солі
Це хімічна реакція, в якій карбонова кислота реагує з неорганічною основою і утворює сіль карбонової кислоти та води, як показано в наступному рівнянні:
ç) реакція елімінації
У цій реакції дві молекули карбонової кислоти зневоднюються, в результаті чого а ангідрид і вода, як показано в наступному рівнянні:

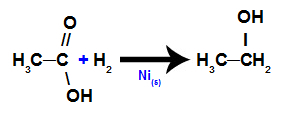
г) Відновлення карбонових кислот
У цій реакції карбонова кислота піддається впливу середовища, що містить газоподібний водень (H2) і твердого нікелю, що призводить до утворення спирту, як показано в наступному рівнянні:
Застосування карбонових кислот
Виробництво органічних ефірів;
Виробництво солей карбонової кислоти;
Приготування парфумерії;
Виробництво оцту;
Виробництво штучного шовку;
виробництво дезінфікуючих засобів;
Фарбування тканин.
Мені Діого Лопес Діас
Джерело: Бразильська школа - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-acidos-carboxilicos.htm
