Гідрування відбувається з ненасиченими ациклічними вуглеводнями, тобто з відкритими ланцюгами з подвійними або потрійними зв’язками, такими як алкени, алкіни та дієни. Це може також відбуватися в ароматичних вуглеводнях, оскільки вони мають подвійні зв’язки в кільці, а також з цикланами (циклоалканами) до п’яти вуглеводнів.
Ці сполуки реагують подібно до газу водню в присутності деякого каталізатора, такого як нікель, платина та паладій, при нагріванні. Таким чином, відбувається реакція приєднання, в якій зв'язок pi (π) розривається, утворюючи два нових одинарних зв’язки, і водень вводиться в молекулу.
Загалом ми маємо:
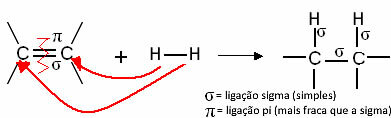
Загальна реакція гідрування
Тепер давайте розглянемо кілька прикладів:
- Гідрування до алкенів: Отриманий продукт - алкан.
Нижче ми маємо реакцію гідрування етилену (або етилену) з отриманням етану:
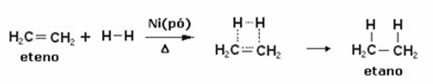
Приклад реакції гідрування етилену
Цей тип каталітичного гідрування використовується харчовою промисловістю для отримання напівтвердих жирів, таких як маргарини. Рослинні олії та жири відрізняються лише тим, що олії мають довгі молекули з подвійними зв’язками між вуглецями, тоді як жири мають лише одинарні зв’язки між ними вуглеці.
Таким чином, щоб перетворити олію в жир, досить гідрувати олію. Таким чином ваші подвійні зв’язки будуть розірвані та перетворені в одинарні. Результатом є отримання дзвінків гідровані рослинні жири.
- Гідрування алкіну: Оскільки алкіни мають два пі-зв’язки, їх повне гідрування відбувається у дві стадії, на першій утворюється алкен, а на другій - алкан.
У реакції нижче ми маємо гідрування пропіну з остаточним утворенням пропану:
1-й крок: H3C C ≡ СН + H2 → H3C CH═ ÇH2
2 етап: H3C CH═ ÇH2 + 2 години2 → H3C CH2─ ÇH3
Якщо ми хочемо, щоб ця реакція зупинилася на першому етапі, ми повинні використовувати якусь речовину, яка зупиняє дію каталізатора.
- Гідрування дієнів: Існує три типи дієнів: накопичений (подвійні зв’язки з’являються нижче), ізольовані (подвійні зв'язки розділені принаймні двома одинарними зв'язками) і кон'югати (подвійні зв’язки з’являються по черзі).
Гідрування накопичених та ізольованих дієнів відбувається так само, як ми бачили для алкенів, але подвійне, оскільки дієни мають більшу ненасиченість. Дивіться два приклади:
* Приклад гідрування в накопиченому дієні:
H H H
│ │ │
H3C CH ═ Ç ═ СН ─ СН3 + 2 години2 → H3C CH ─ Ç ─ СН ─ СН3
│ │ │
H H H
* Приклад гідрування в ізольованому дієні:
H H H H
│ │ │ │
H3C CH ═ CH─CH2 ─ СН ═ СН ─ СН3 +2 год2 → H3C CH ─ CH─CH2 ─ СН ─ СН ─ СН3
З іншого боку, гідрування кон'югованих дієнів може відбуватися двома шляхами: з додаванням 1,2 та додаванням 1,4. Найпоширенішим є додавання 1,2, при якому до вуглецю, що утворює подвійний зв’язок, додаються водні при низьких температурах. З іншого боку, додавання 1,4 відбувається при підвищених температурах, і це коли виникають резонанс і поява вільних валентностей у вуглецях 1 і 4. Перегляньте приклади кожного випадку:
* Приклад додавання 1,2 в кон'юговані дієни:
H2C CH ─ СН ═ СН2 + H2 → H2C CH ─ C ─ CH СН2
│ │
Н Н
* Приклад додавання 1.4 у спряжених дієнах:
H2C CH ─ СН ═ СН2 + H2 → H2C CH ═ СН СН2
│ │
Н Н
- Гідрування ароматичних речовин: Пі-зв’язки бензольного кільця розриваються, а атоми водню додаються до вуглеців, що утворюють ці зв’язки.
Цей тип загального гідрування показано нижче:

Реакція гідрування загального бензолу
- Гідрування циклану: Відбувається утворення алкану.
Приклад: Гідрування циклопропану:
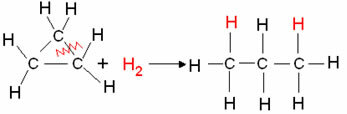
Реакція гідрування циклопропану
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/reacao-organica-hidrogenacao.htm
