Для хімічної реакції необхідно задовольнити чотири основні умови, а саме:
1. Реагенти повинні контактувати;
2. Між реагентами має бути хімічна спорідненість;
3. Зіткнення між частинками реагенту повинні бути ефективними;
4. Потрібно досягти енергії активації.
Коротко перегляньте кожен випадок:
1.Контакт між реагентами:
Ця умова очевидна, оскільки навіть якщо реагенти мають велику спорідненість між собою, як у випадку кислот і основ, якщо їх розділити, реакція не відбудеться. Їм потрібно встановити контакт, щоб їх частинки могли зіткнутися, порушуючи зв’язки реагентів і утворюючи зв’язки продуктів.

2.Хімічна спорідненість:
Як ми вже бачили, приведення реагентів у контакт необхідно, але недостатньо. Наприклад, якщо ми введемо натрій у контакт з водою, відбудеться надзвичайно бурхлива реакція, але якщо ми введемо золото, ми не побачимо ніякої різниці. Це пов’язано з тим, що різні речовини мають різну хімічну спорідненість між собою, або вони можуть взагалі не мати подібності. Чим більше хімічна спорідненість, тим швидша реакція.
У згаданих прикладах натрій має велику спорідненість з водою, так що, щоб не контактувати з вологою в повітрі, металевий натрій зберігається в гасі. Золото є інертним, саме тому золоті пам’ятники служать так довго, як саркофаги Єгипту.

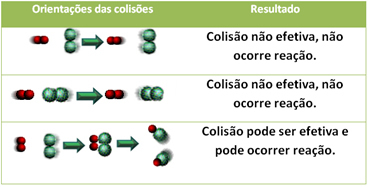
3.Теорія зіткнень:
Навіть у сполуках, які мають хімічну спорідненість, для протікання реакції необхідно, щоб їх частинки, атоми або молекули ефективно стикалися. Не всі частинки, які стикаються, роблять це ефективно, але удари, що призводять до розриву реагентні зв’язки та утворення нових зв’язків - це ті, що відбуваються у правильній орієнтації та з енергією достатньо.
Нижче наведено випадок двох неефективних зіткнень та одного ефективного зіткнення, в результаті якого відбувається реакція.
4.Енергія активації та активований комплекс:
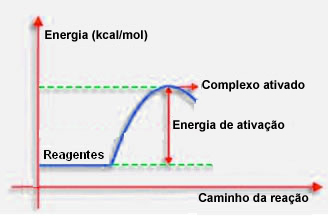
Як зазначалося в попередньому пункті, для ефективного зіткнення, крім сприятливого керівництва, також потрібна достатня кількість енергії. Мінімальна кількість енергії, необхідна для здійснення кожної реакції, називається енергією активації.
Якщо енергія реагентів дорівнює або перевищує енергію активації, під час добре орієнтованого удару, утворюється спочатку активований комплекс, який є проміжною структурою між реагентами та продуктів. В активованому комплексі є ослаблені зв’язки реагентів і утворення нових зв’язків продукту.
Таким чином, енергія активації працює як своєрідний бар'єр для реакції, оскільки чим вона більша, тим складніше буде реакції. У деяких випадках необхідно подавати енергію до реагентів. Наприклад, газ для готування має спорідненість до взаємодії з киснем у повітрі, але нам потрібно подавати енергію, коли ми поєднуємо сірник, інакше реакція не відбувається. Але після запуску сама реакція виділяє достатньо енергії, щоб активувати інші молекули і підтримувати реакцію.
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm
