В хімічні зв’язки - це взаємодії, що відбуваються між атомами, щоб стати молекулою або основною речовиною сполуки. Існує три типи посилань: ковалентний, металевий і іонний. Атоми прагнуть, укладаючи хімічний зв’язок, стабілізуватись в електронному вигляді. Цей процес пояснюється теорія октету, який диктує, що для досягнення стійкості кожен атом повинен мати вісім електронів у своїй валентній оболонці.
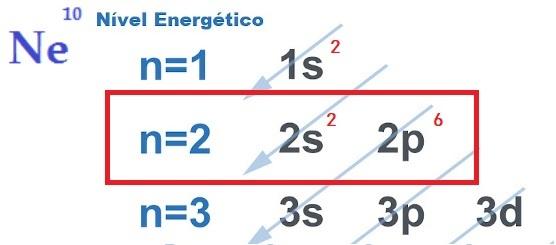
Хімічні зв’язки та правило октетів
THE пошук електронної стабільності, що виправдовує здійснення хімічних зв'язків між атомами, пояснюється теорія октету. Запропонована Ньютоном Льюїсом, ця теорія стверджує, що атомна взаємодія відбувається так, що кожен елемент набуває стабільності благородного газу, тобто вісім електронів в валентний шар.
Для цього елемент давати, отримувати або ділитися електрони з її зовнішньої оболонки, отже, утворюючи хімічні зв’язки іонного, ковалентного або металевого характеру. ти благородні гази вони є єдиними атомами, які вже мають вісім електронів у своїй зовнішній оболонці, і тому вони мало реагують з іншими елементами.
Дивисьтакож: Правила електронного розповсюдження: як це зробити?
Види хімічних зв’язків
Щоб отримати вісім електронів у валентній оболонці, як передбачається правилом октету, атоми зв’язуються між собою, які варіюються залежно від потреби віддавати, приймати або ділитися електронами, а також природи зв’язуючих атомів.
іонні зв’язки
Також відомий як електровалентні або гетерополярні зв’язки, трапляються між металів і дуже електронегативні елементи (метали та водень). У цьому типі дзвінка метали, як правило, втрачають електрони, перетворюючись на катіони (позитивні іони), а неметали та водень отримують електрони, перетворюючись на аніони (негативні іони).
ти іонні сполуки тверді і крихкі, мають високу температуру кипіння і поведінку електричний струм коли вони перебувають у рідкому стані або розведені у воді.
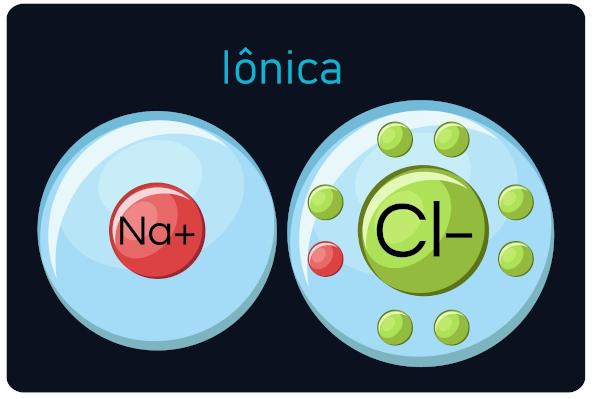
Спостереження: Майте на увазі, що атом, який отримує електрони, стане іоном із негативним знаком, а атом, який втрачає електрони, стає позитивним знаком.
Приклади іонних речовин:
- Бікарбонат (HCO3-);
- Амоній (NH4+);
- Сульфат (SO4-).
Щоб дізнатись більше про цей тип хімічного зв’язку, відвідайте наш текст: іонні зв’язки.
ковалентні зв’язки
В ковалентні зв’язки трапляються обмін електронами. Через низьку різницю в електронегативності між зв'язуючими елементами вони не віддають і не приймають електрони, а ділитися електронними парами щоб вони були стабільними згідно з правилом октету. Цей тип зв’язку дуже поширений у простих елементах, таких як Cl2, H2, О2, а також у вуглецевих ланцюгах. різниця в електронегативність між лігандами визначає, є зв'язок полярною чи неполярною.

Читайте також:Полярність молекул: як ідентифікувати?
дативний ковалентний зв’язок
Також називається координатний ковалентний зв’язок, напівполярний, дативний або координатний зв’язок, він дуже схожий на ковалентний зв’язок, різниця між ними полягає в тому, що один з атомів у давному зв’язку відповідає за розподіл двох електронів. У цьому типі зв’язку це відбувається штучно, молекула набуває тих самих характеристик, що і молекула, що виникає в результаті спонтанного ковалентного зв'язку.
Металеві ланки
Цей тип зв’язку відбувається між металами, які включають елементи сімейства 1A (лужні метали), 2A (лужноземельні метали) та перехідні метали (блок B періодичної таблиці - групи 3-12), утворюючи те, що ми називаємо металеві сплави. Диференціальною характеристикою щодо інших типів з'єднання є рух електронів, що пояснює той факт, що металеві матеріали у твердому стані є чудовими електричними та тепловими провідниками. Крім того, металеві сплави мають високу температуру плавлення і кипіння, пластичність, пластичність і блиск. Прикладами металевих сплавів є:
сталь: залізо (Fe) і вуглець C;
бронза: мідь (Cu) + олово (Sn);
латунь: мідь (Cu) + цинк (Zn);
золото: золото (Au) + мідь (Cu) або срібло (Ag).

Резюме
- Хімічні зв'язки: взаємодія між атомами, які прагнуть електронної стабільності.
- Типи дзвінків: іонні, ковалентні та металеві.
- Правило октету: визначає, що для того, щоб атом був стабільним, він повинен мати вісім електронів у валентній оболонці.
розв’язані вправи
питання 1 - (Mackenzie-SP) Щоб атоми сірки та калію набули електронну конфігурацію, рівну конфігурації благородного газу, необхідно:
(Дані: атомний номер S = 16; K = 19).
а) сірка отримує 2 електрони, а калій - 7 електронів.
б) сірка дає 6 електронів, а калій - 7 електронів.
в) сірка дає 2 електрони, а калій - 1 електрон.
г) сірка отримує 6 електронів, а калій - 1 електрон.
д) сірка отримує 2 електрони, а калій - 1 електрон.
Дозвіл
Альтернатива Е. Оскільки сірка входить до сімейства 6А або 16, підкоряючись правилу октету, їй потрібно придбати 2 електрони, щоб у валентній оболонці було 8. З іншого боку, калій, який належить до першого сімейства періодичної системи (1А або сімейства водню), щоб мати у своєму валентному шарі конфігурацію благородного газу, йому потрібно втратити 1 електрон. Поєднавши 2 атоми калію з 1 атомом сірки, ми можемо встановити іонний зв’язок, в якому обидва елементи є електрично стійкими.
питання 2 - (UFF) Грудне молоко - це їжа, багата органічними речовинами, такими як білки, жири та цукри, та мінеральними речовинами, такими як фосфат кальцію. Ці органічні сполуки мають основною характеристикою ковалентні зв’язки при утворенні їх молекул, тоді як мінерал також має іонний зв’язок. Перевірте альтернативу, яка правильно представляє поняття ковалентного та іонного зв’язків відповідно:
а) Ковалентний зв’язок відбувається лише в органічних сполуках.
б) Ковалентний зв’язок здійснюється шляхом переносу електрона, а іонний зв’язок відбувається шляхом обміну електронами з протилежними спінами.
в) Ковалентний зв’язок утворюється шляхом притягання зарядів між атомами, а іонний зв’язок - поділом заряду.
г) Ковалентний зв’язок утворюється з’єднанням атомів у молекулах, а іонний з’єднанням атомів у хімічних комплексах.
д) Ковалентний зв’язок здійснюється шляхом обміну електронами, а іонний - за допомогою переносу електронів.
Дозвіл
Альтернатива Е.
Давайте подивимось на інші:
- Альтернатива: неправильні, оскільки ковалентні зв’язки трапляються і в неорганічних сполуках, таких як CO2.
- Альтернатива b: неправильна, оскільки ковалентні зв’язки виникають шляхом спільного використання, а іонні зв’язки - за допомогою переносу електрона.
- Альтернатива c: І ковалентний зв’язок, і іонний зв’язок виникають через потребу втратити або отримати електрони, а не через електростатичне притягання між ядрами.
- Альтернатива d: Обидва зв’язки, як ковалентні, так і іонні, виникають через об’єднання атомів у молекулі.
питання 3 - (PUC-MG) Перегляньте таблицю, яка показує властивості трьох речовин, X, Y та Z, в умовах навколишнього середовища.
| Речовина | Температура плавлення (c °) | електропровідність | Розчинність у воді |
| х | 146 | жоден |
розчинний |
| р | 1600 | високий | нерозчинний |
| z | 800 | просто розтоплений або розчинений у воді | розчинний |
Враховуючи цю інформацію, ПРАВИЛЬНО стверджувати, що речовини X, Y та Z є відповідно:
а) іонний, металевий, молекулярний.
б) молекулярний, іонний, металевий.
в) молекулярний, металевий, іонний.
г) іонні, молекулярні, металеві.
Дозвіл
Альтернатива C.
Речовина X є молекулярною, як молекулярні зв'язки, також звані ковалентами, мають низьку температуру кипіння, оскільки різниці в електронегативності між лігандами немає дуже високий. Як правило, ковалентні сполуки не мають електропровідності, і розчинність є змінною.
Ми можемо розпізнати речовину Y як металеву, оскільки метали мають високу температуру плавлення, є чудовими електричними провідниками і не розчиняються у воді.
Нарешті, речовина Z є іонною, оскільки температура плавлення для цієї речовини відносно висока, що є наслідком кристалічного розташування молекули. Коли іонна речовина розчиняється у воді або в рідкому стані, у ній є вільні іони, що робить її електропровідною та водорозчинною.
Лайса Бернардес Марк
Вчитель хімії
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/ligacoes-quimicas.htm
