трапляється перетворенняізохорний коли дана маса газу зазнає змін у температури що спрацьовують зміни тиску або навпаки, враховуючи, що температура і тиску, в даному випадку, є прямо пропорційними величинами, тоді як обсяг системи залишається незмінним.
Дивіться також: Що таке парціальний тиск газів?
Що таке ізохорне перетворення?
Ізохорне перетворення - це коли зміна температури та тиску відбувається з даною масою газу, але його об’єм залишається незмінним. Зміна тиску буде прямо пропорційна температурі, тобто якщо газ у певній закритій системі подвоїть свою абсолютну температуру, це призведе до збільшення тиску вдвічі більше, ніж було спочатку.
Цей тип трансформації також називають ізоволюметрична або ізометрична. Ізохоричний термін походить від грецької Ісохора, про те, що ізо означає "рівний" і хора означає "місце або обсяг" (у цьому контексті).
Приклади:
Шини автомобіля зазнають ізохоричного перетворення, ми можемо спостерігати це, коли робимо його калібрування. У спекотні дні тиск, що подається на калібрувальний монітор, вищий, ніж у холодні дні. Це пов’язано з тим, що зі збільшенням температури тиск зростає, оскільки об’єм залишається.

Іншими прикладами є спрей-дезодоранти, на цьому типі продукції на етикетці є попередження не зберігати та не піддавати дії високих температур, оскільки, окрім того, що деякі його речовини є займистими, існує умова ізохорного перетворення або ізоволюметричний. Оскільки аерозольні дезодоранти знаходяться всередині герметичної пляшки та у газоподібному стані, то підвищення температури призведе до підвищення тиску та ризику вибуху.
Характеристика ізохоричного перетворення
- Постійний обсяг.
- Тиск і температура прямо пропорційні.
Ці характеристики можна описати за такими формулами:

Графік ізохорної функції
Зверніть увагу на наступну таблицю, яка описує поведінку газу щодо тиску, температури та отриманої константи.
Температура (° C) |
Тиск (атм) |
P / T = постійна |
50 |
5 |
10 |
100 |
10 |
10 |
150 |
15 |
10 |
200 |
20 |
10 |
Зверніть увагу, що тиск слід за підвищенням температури, так що співвідношення P / T залишається постійним, що означає, що тиск і температура є прямо пропорційними величинами. Отже, графік, що описує ізохорні перетворення, має лінійний тип. Подивіться:

Хто відкрив ізохорне перетворення?
Жак Александр Сезар Шарль (1746-1823) - французький вчений, який, вивчаючи поведінку газів у замкнутій системі для створення прецизійного термометра, завершив дослідження з ізохорних перетворень.
Науковець Джозеф Луї Гей-Люссак (1778-1850) також розробив дослідження щодо розширення та усадки газоподібної системи. Це були незалежні аналізи, але оскільки вони дійшли того самого висновку, вони розділили кредити. Сьогодні деякі автори посилаються на два останні фізичні закони газів, які пояснюють ізобаричні перетворення і ізохоричний подібний 1-й і 2-й закони Шарля-Гей-Люссака.
Дивіться також: Об'ємний закон Гей-Люссака
Вправивирішено
Питання 1 - (PUC-RJ) Велосипедна шина калібрується під тиском 4 атм, в холодний день, при температурі 7 ° C. Обсяг і кількість впорскуваного газу однакові. Яким буде тиск калібрування в шині, коли температура досягне 37 ° С?
а) 21,1 атм
б) 4,4 атм
в) 0,9 атм
г) 760 мм рт. ст
д) 2,2 атм
Дозвіл
Альтернатива A
Перший крок: визначте систему та витягніть дані.
Ізооб'ємна система
P1 = 4 атм
Т1 = 7 ° С
Т2 = 37 ° С
P2 =?
Використовуючи формулу:
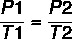
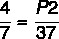
7 x P2 = 37 x 4
Р2 = 148/7
Р2 = 21,14 атм
Питання 2 - (Unifor-CE) Вивчіть малюнок нижче.
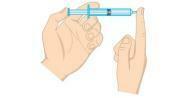
Тиск газу всередині шприца можна зменшити:
а) поміщаючи шприц у крижану воду, тримаючи кінець закритим.
б) стискаючи поршень, тримаючи кінець закритим.
в) поміщення шприца в гарячу воду, тримаючи кінець закритим.
г) відкриття наконечника і витягання половини повітря зі шприца.
д) витягування поршня, тримаючи кінець відкритим.
Дозвіл
Альтернатива А. Тиск газу прямо пропорційний температурі в ізохорній системі, тобто без зміни об'єму або маси газу. Коли спостерігається зниження температури, також відбуватиметься падіння тиску.
Автор: Лайса Бернардес, Marques de Araujo
Вчитель хімії
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/transformacao-isocorica.htm

