Ізобаричне перетворення відбувається, коли газ знаходиться під постійним тиском. Наприклад, якщо це зробити у відкритому середовищі, перетворення буде ізобарним, оскільки тиск буде таким атмосферним тиском, який не зміниться.
У цьому випадку температура і об’єм змінюються. Два провідні вчені вивчали, як відбувається ця зміна в ізобаричних перетвореннях. Першим, що зв'язав об'єм і температуру газів, був Жак Шарль (1746-1823), в 1787 році, а потім, у 1802 році, Джозеф Гей-Люссак (1778-1850) дав кількісну оцінку цих зв'язків.
Таким чином, з’явився закон, що пояснює ізобаричні перетворення газів, який став відомим як закон Чарльза / Гей-Люссака. Це зазначено наступним чином:
"У системі постійного тиску об'єм фіксованої маси газу прямо пропорційний температурі".

Це означає, що якщо ми подвоїмо температуру, об’єм газу також подвоїться. З іншого боку, якщо ми зменшимо температуру, обсяг газу також зменшиться в тій же пропорції.
Це можна побачити на дуже простому експерименті. Якщо ми помістимо повітряну кулю в горлечко пляшки, фіксована маса повітря потрапить у пастку. Якщо ми зануримо цю пляшку в миску з крижаною водою, повітряна куля здується. Тепер, якщо ми помістимо його в миску з гарячою водою, повітряна куля наповниться.
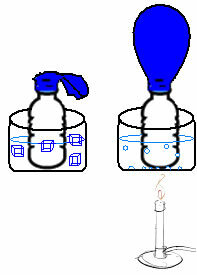
Це пов’язано з тим, що зі збільшенням температури кінетична енергія молекул газу зростає, і швидкість, з якою вони рухаються, також зростає. Таким чином, газ розширюється, збільшуючи об’єм, який він займає, і повітряна куля надувається. Навпаки відбувається, коли ми знижуємо температуру, поміщаючи її в холодну воду.
Не зупиняйтесь зараз... Після реклами є ще щось;)
Цей взаємозв'язок між температурою та об'ємом в ізобаричних перетвореннях задається наступним співвідношенням:
V = k
Т
"k" - константа, як видно з наступного графіку:
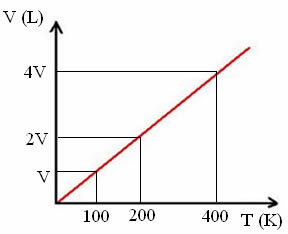
Зверніть увагу, що співвідношення V / T завжди дає константу:
_V_ =_2V_ = _4V_
100 200 400
Таким чином, ми можемо встановити такий взаємозв'язок для ізобаричних перетворень:
Vпочатковий = VОстаточний
Тпочатковий ТОстаточний
Це означає, що коли відбувається якась зміна температури газу при постійному тиску, ми можемо знайти його об’єм за допомогою цього математичного виразу. Вірно і навпаки, знаючи об’єм газу, ми з’ясовуємо, при якій температурі він знаходиться. Дивіться приклад:
"Газова маса займає об’єм 800 см3 при -23 ° C, при заданому тиску. Яка температура реєструється, коли газоподібна маса за однакового тиску займає об'єм 1,6 л? "
Дозвіл:
Дані:
Vпочатковий = 800 см3
Тпочатковий = -23 ºC, додаючи до 273, ми маємо 250 К (Кельвін)
VОстаточний = 1,6 л
ТОстаточний = ?
* Спочатку ми повинні залишити гучність на тій же одиниці. Відомо, що 1 дм3 дорівнює 1 літру. як 1 дм3 - це те саме, що 1000 см3, виявляється, що 1 літр = 1 000 см3:
1 л 1000 см3
х 800 см3
х = 0,8 л
* Тепер ми замінюємо значення формули і знаходимо кінцеве значення температури:
Vпочатковий = VОстаточний
Тпочатковий ТОстаточний
0,8_ = 1,6
250 тОстаточний
0,8 ТОстаточний = 250. 1,6
ТОстаточний = 400
0,8
ТОстаточний = 500K
* Переходячи до шкали Цельсія, ми маємо:
T (K) = T (° C) + 273
500 = T (° С) + 273
T (° С) = 500 - 273
Т (° С) = 227 ° С
Дженніфер Фогача
Закінчив хімію
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
FOGAÇA, Дженніфер Роша Варгас. «Ізобарне перетворення»; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/transformacao-isobarica.htm. Доступ 27 червня 2021 року.
Що таке гази, які властивості газів, молекулярні сполуки, стисливість, фіксований об’єм, кінетична енергія середнє значення, абсолютна температура газу, ідеального газу, реальні гази, ідеальний газ, змінні стану газу, об’єм газу, пори року
Хімія

Закони Гей-Люссака, закон Пруста, хімічна реакція, постійна частка, маси речовин, чиста речовина, аналіз якісні та кількісні, закон досконалих газів, закон постійних пропорцій, закон певних пропорцій, закон об'ємні.



